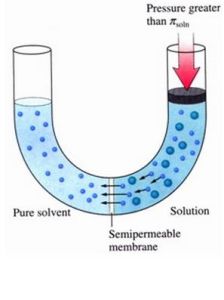
基本定義
恰好能阻止滲透發生的施加於溶液液面上方的額外壓強稱為滲透壓力(簡稱滲透壓)。影響因素
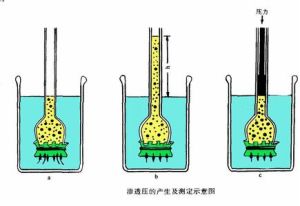 滲透壓
滲透壓(1)在溫度一定時,稀溶液的滲透壓力與溶液的濃度成正比
(2)在濃度一定時,稀溶液的滲透壓力與熱力學溫度成正比
1886年荷蘭理論化學家范托夫(van'tHoff)從理論上推導出難揮發非電解質稀溶液的滲透壓力與溶液濃度和熱力學溫度的關係為:
上式稱為范托夫公式,也叫滲透壓公式。其中R為理想氣體常數,當π的單位為Pa,V的單位為升(L)時,R值為8.314J·K-1·mol-1。
范托夫公式表示,在一定溫度下,溶液的滲透壓與單位體積溶液中所含不能通過半透膜的溶質的粒子數(分子數或離子數)成正比,而與溶質的本性無關。
溶液滲透壓
解釋所謂溶液滲透壓,簡單的說,是指溶液中溶質微粒對水的吸引力。溶液滲透壓的大小取決於單位體積溶液中溶質微粒的數目:溶質微粒越多,即溶液濃度越高,對水的吸引力越大,溶液滲透壓越高;反過來,溶質微粒越少,即與無機鹽、蛋白質的含量有關。在組成細胞外液的各種無機鹽離子中,含量上占有明顯優勢的是Na+和Cl-,細胞外液滲透壓的90%以上來源於Na+和Cl-。在37℃時,人的血漿滲透壓約為770kPa,相當於細胞內液的滲透壓。
依數性質
由於平衡滲透壓遵循理想氣體定律(稀溶液中忽略溶質分子的相互作用),這個數學推導過程在這裡省略,最後可以得出范特霍夫關係:π=cRT(或π=kTN/V;N/V為分子數密度),從公式可知溶液的滲透壓只由溶質的分子數決定,因而滲透壓也是溶液的依數性質。這個關係給出的不是真正的壓強,而是阻止滲透流可能需要的壓強,即系統達到平衡所需要的壓強差。
細胞相關
植物細胞以滲透吸水為主,其動力就是滲透壓。那么滲透壓對細胞的世界究竟有多大意義呢?我們還必須拿具體的數據來說明,假設細胞半徑為R,由於滲透壓膨脹變為R+dR,這樣面積的增加為dA=8πRdR,其能量消耗為Σ×dA。如要讓細胞膨脹達到平衡,就是讓自由能pdV等於表面張力,通過計算可以得到拉普拉斯公式:Σ=Rp/2。如果紅細胞在純水中,阻止水進入細胞的壓強為300pa,假設細胞直徑10μm,對細胞來說有多大呢?代入估算的p得到Σ=10-5m×300pa/2=1.5×10-3Nm-1。這個力足夠撕開真核細胞,將細胞摧毀。所以你不能用純水來稀釋紅細胞,這樣他們會爆裂,即溶胞。疏水作用
排空效應是疏水作用(疏水力實質是熵和自由能的混合效應)的理想情況,而滲透壓是使大分子產生這種排空力的原因。滲透壓可以看成單位體積內的自由能變化。排空效應是小顆粒能把大顆粒推到一起,以使小顆粒自身的熵最大,如果兩個表面精確匹配,則相應的單位接觸面積上的自由能減少為ΔF/A=ckBT×2R,R為小顆粒半徑(這裡的c不是濃度是分子數密度)。小顆粒能夠有效的幫助大分子找到彼此特異性識別位點,在生物學實驗中,常用血清蛋白(BSA)和聚乙二醇(PEG)充當小顆粒它們稱為阻塞試劑。比如他們可以幫助脫氧血紅蛋白和其他大蛋白粘在一起,溶解性降低10倍;葡聚糖或PEG能穩定複合物不受熱分解,可以使DNA熔解溫度增加若干;PEG和BSA還能使機動蛋白絲自組裝速率或不同酶的活性增加幾個數量級;在大腸桿菌DNA複製系統中如果不加入阻塞試劑就不能工作。選擇何種阻塞試劑並不重要,關鍵是他相對組裝分子的尺度及數密度。這是無序狀態過程中同時驅動的有序組裝,這個的有序是以更小顆粒更大的無序為代價的。