簡介
 肝細胞
肝細胞肝細胞為多角形,直徑約為20-30/加(微米),有6-8個面,體積約4g0/皿3,不同的生理條件下大小有差異,如飢餓時肝細胞體積變大。分離的單個肝細胞的直徑最大可達20-30μm,細胞體積約4900μm3,表面積約1700μm2(微絨毛不計算在內),每個肝細胞的表面可分為肝竇(血竇)面、毛細胞膽管面和相鄰的肝細胞面。生活狀態的肝細胞有一定的彈性,不同的動物和不同的生理狀態體積變化較大。
結構
每個肝細胞表面可分為竇狀隙面、肝細胞面和膽小管面三種。肝細胞裡面含有許許多多複雜的細微結構:如肝細胞核、肝細胞質、線粒體、內質網、溶酶體、高爾基氏體、微體及飲液泡等組成。每一種細微結構都有極其重要而複雜的功能,這些功能保證了人的生命的存在,保證了人能夠活下去。
肝細胞核
 肝細胞核
肝細胞核肝細胞質
肝細胞質內有豐富的細胞器和包涵物,he染色切片中胞質呈細顆粒狀,它的結構可因肝細胞的功能和營養狀態不同而有很大的變化。所謂“細胞器”一般是指有特定的形態的恆定的結構。如線粒體、內質網、高爾基複合體(器)、溶酶體等,細胞質內嗜鹼性顆粒(或小體),即為聚集的粗面內質網和核蛋白體。“包涵物”是指易隨肝細胞不同生理狀態而變化的不恆定物質。如糖原和脂類物質、色素(脂類素、膽色素),特別是肝糖原和脂類物質的合成和儲存,受狀況的變化很大。常規he染色切片中糖原和脂質大多消失,胞質中的小空隙即為糖原的所在處;脂質則呈空泡狀。這些物質的消失,多數是在製片過程脫水、透明等步驟中因溶解和洗脫所致;只有用特殊的組織學和組織化學方法方能顯示。飢餓狀態動物的細胞質內嗜鹼性物質減少或消失,糖原消失;但脂質增多,這時肝細胞質呈嗜酸性,he染色標本胞漿呈紅色。肝細胞膜
一般為雙層完整的膜,厚約90-100nm。由於每個肝細胞分別與肝竇面、毛細膽管面、相鄰的肝細胞面等六個面或更多的面相接觸,因此三種不同面的肝細胞膜的功能不同,故結構上也各有特點。線粒體
肝細胞的線粒體很多,每個細胞大約有1000個左右,遍布於胞質內。肝小葉不同部位肝細胞內線粒體的大小和形
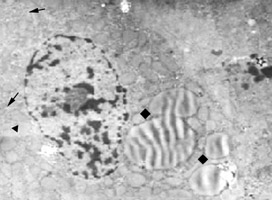 肝細胞的線粒體
肝細胞的線粒體在線粒體嵴的表面和內界膜的基質面上附有密集排列的、火柴頭狀的亞單位,稱為基粒。其粒由約10nm的球形頭部與寬約3.5nm、長約5nm的短柄構成。頭部伸入基質,相當於ATP合成酶所在處,是氧化磷酸化最終合成ATP酶的一部分。柄的一端與嵴的界膜相連,是一聯接蛋白,脂類和胺基酸線上粒體內被氧化成水和二氧化碳,所釋放的能量則通過這種連線蛋白轉給ADP生成ATP。線粒體的亞單位只有在特殊處理的標本中,如將線粒體由細胞勻漿中分離出來,並用低滲法破壞其界膜,使其嵴暴露,再用磷鎢酸復染,方可看到。而普通超薄切片則見不到這種亞單位,這是因為鋨酸固定時,球形頭部被解聚所致。
線粒體內外界膜的通透性和化學組成互不相同。外界膜對大多數分子量小於10000的低分子溶質而言,均可自由通過,而內界膜則僅允許不帶電荷、相對分子量小於150的小分子如水、O2、CO2、尿素及甘油等通過,葡萄糖、K+、Na+、Cl-等均不能通過內膜。線粒體基質內常見一些小的電子緻密顆粒,稱為線粒體內顆粒或基質顆粒。基質顆粒內含Ca2+、Mg2+等離子。
線粒體基質內含有蛋白質(包括各種酶類、類脂質成分、DNA、RNA及核蛋白體),除此之外,還有各種單核苷酸和輔酶。由於線粒體膜和基質內含有大量酶類,如含有進行氧化作用的呼吸鏈的酶體系,氧化磷酸化酶體系、三羧酸循環及脂肪酸氧化的酶體系等,各種代謝物質線上粒體內氧化,並把放出的能量轉換成ATP。因此,線粒體像一個能源中心,一個電力發動站,能向細胞不斷提供其生命活動所必需的能量,以保證和推動細胞進行各種複雜的生理功能。
由於線粒體還含有自身的基因物質——脫氧核糖核酸,稱線粒體脫氧核糖核酸(mt DNA)或稱染色體外脫氧核糖核酸其含量約占一個細胞全部DNA的2%。此外,線粒體內還含有DNA聚合酶,KNA聚合酶,胺基酸活化酶,tRNA及mRNA。因而能自我複製和合成蛋白質,自行分裂、繁殖和增生。線粒體是細胞內最為敏感的細胞器之一。在許多病理情況下,線粒體常常首先發生各種形態改變,最常見的有線粒體腫脹,線粒體增生、肥大以及線粒體內包含物的產生等。
內質網
肝細胞的內質網很豐富,分布廣泛。它與高爾基複合體及核膜共同構成一連續的細胞區域網路狀膜系統。按其囊膜表
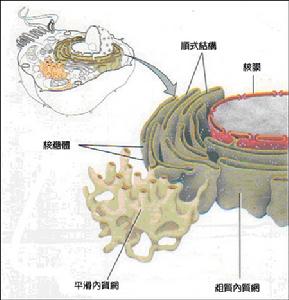 內質網
內質網1、粗面內質網RER形成池(cistem),在其膜外面附著有核蛋白體,據測定,1mg肝組織中所含內質網的總面積約為11m2,其中約2/3為RER。在肝小葉的不同區帶其分布是不相同的。肝小葉周邊帶的肝細胞內,RER尤為豐富。光面內質網則相反,在小葉中央帶及中間帶肝細胞內較小葉周邊帶肝細胞內為多。這種數量上的分布差異與小葉不同區帶內肝細胞的功能特性有關。在一個細胞中,RER的主要功能為生成輸出蛋白(或稱分泌蛋白),如血漿白蛋白、α、β球蛋白、纖維蛋白原、凝血酶原等,均在RER上合成。新合成的蛋白質貫穿內質網膜進到內腔,經由運輸小泡運至高爾基複合體,在此加工、濃縮、再經分泌泡從細胞表面釋放入肝竇內。
RER的發達程度反映著肝細胞的功能狀態。各種損傷因子引起的肝細胞損傷,亦可反映於RER,其最常見的改變為RER膜上多聚核蛋白體解聚(disaggregation)及脫粒(degranulation)。解聚是指多聚核蛋白體分散為單體,游離分散在細胞質中,或附在粗面內質網膜上。脫粒則指附著在RER膜上的核蛋白體脫落下來,多以單體形式散在胞質之中。如四氯化碳中毒所致肝細胞損害時,可見RER膜上多聚核蛋白體解聚及脫粒,此時,蛋白質合成也聚降。肝癌時,RER數量與腫瘤細胞的生長率及惡性程度之間存在一種反相關關係,在分化較高、生長緩慢的癌細胞中,RER較發達,反之,在分化低,生長迅速的肝癌細胞中,RER則往往很少,而游離的多聚核蛋白體卻十分豐富,以適應癌細胞快速生長的需要。
2、光面內質網(SER) SER膜上不附有核蛋白體,由分支的小管組成,並與RER相連繫,也可由RER形成。SER在肝細胞中具多種功能,如參與糖原代謝、膽汁分泌、脂類代謝、類固醇激素代謝及解毒等。SER常位於胞漿一側,與糖原顆粒相伴隨,若糖原很豐富時,常可遮蓋SER使之分辨不清。在飢餓時,糖原減少,肝細胞內SER則較為明顯。由於SER含有葡萄糖-6磷酸酶,加之與糖原結構空間的緊密關係,因而更有利於糖原代謝。
SER與膽汁分泌有關,非結合性膽紅素從血液進入肝細胞後,經SER上的葡萄糖醛酸轉移酶作用,成為水溶性結合膽紅素而利於排泄,膽鹽也在SER上合成。此外,SER還參與脂肪代謝。血液內游離脂肪酸進入肝細胞後,在SER上醯化成甘油三酯,經與RER合成的蛋白質結合,形成極低密度脂蛋白進入血竇。
肝臟的解毒功能亦在SER上進行。由於SER內含有混合功能氧化酶系,其中終末氧化酶即細胞色素P-450,對許多有害物質如機體代謝產物、藥物、致癌劑、殺蟲劑等均可加以代謝,從而或被解除毒性,或被轉化為易於排泄的物質。由此不難理解,在慢性藥物中毒過程中(如安眠藥、巴比妥類中毒)可見到SER膜的增生。SER膜的增生還見於長期用抗組織胺藥物,口服抗糖尿病藥物和避孕藥時。SER膜的增生,一般屬細胞的一種適應性反應,是功能升高的表現(即酶的誘導)。但並非任何SER的增生均伴有功能的升高,有時往往表現為一種無效增生。在膽汁淤積時,肝細胞內增生的SER則處於低活性狀態。表面抗原陽性的B型肝炎病人,也出現肝細胞內光面內質網增生,在其小管內形成B型肝炎表面抗原。此時的肝細胞由於含有增生的光面內質網,在組織切片上模糊如毛玻璃,故稱毛玻璃細胞。電鏡下,可見光面內質網小管中心呈細絲狀的B型肝炎表面抗原。這在診斷上頗為重要。
核蛋白體
核蛋白體(ribosome)又稱核糖核蛋白體或核糖體,因首先被Palade在電鏡下發現,故又稱palade小體。核蛋白
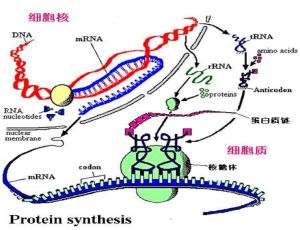 核蛋白體
核蛋白體核蛋白體的主要成分為核蛋白體核糖核酸,它們與蛋白質結合,以核蛋白(RNP)的形式存在。
核蛋白體可以單個存在,即單體,也可以由mRNA細絲將它們串聯一起,構成多聚核蛋白體。多聚核蛋白體是合成蛋白質的功能基團,mRNA穿行於大小亞單位之間的隧道中,新合成的肽鏈便自中央管釋放出來。當特定的主鏈形成後,核蛋白體便從mRNA上離去,並分解成亞單位。需要合成蛋白質時,亞單位再行結合,並進一步組成多聚核蛋白體。因此,在細胞質中,核蛋白體的單體和多聚體總是隨著細胞的功能狀態處於不斷結合和分解的動態變化之中。游離核蛋白體合成的蛋白質主要供肝細胞自身生長、分裂、更新所需。
溶酶體
DeDuve於1955年首次在大鼠肝細胞勻漿超速離心後的各組成分中發現溶酶體的存在,後經電鏡觀察證實。溶酶
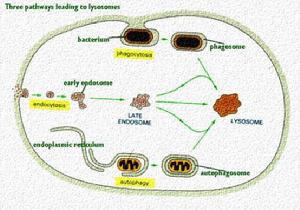 溶酶體
溶酶體1、初級溶酶體此類溶酶體僅含水解酶而無底物,由單層界膜包繞,內含電子緻密的均質物,常位於近高爾基複合體處。初級溶酶體在粗面內質網上合成,經運輸小泡送至高爾基囊泡進行加工、濃縮,再由高爾基扁平囊分泌面末端膨大、分離而形成初級溶酶體。溶酶體所含水解酶能消化各類大分子化合物。在正常生理情況下,該種酶處於非激活狀態,同時,溶酶體膜的內表面還有一層帶電荷的糖蛋白,保護膜不受水解酶的作用。而且,溶酶體膜還具有獨特的濾過性質,只允許分子量小的物質通過。這就保證了大分子的水解酶不能自由逸出膜外,從而保護細胞免於自身消化。
2、次級溶酶體此類溶酶體內除含有水解酶外,還含有相應的作用底物,以及由此形成的消化產物。由於所含底物的不同和消化程度的差異,構成了次級溶酶體形態的多樣性。根據消化底物來源的不同,又可將次級溶酶體分為自生性、異生性和兼性三種。
高爾基氏體
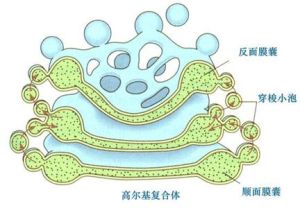 高爾基體
高爾基體1、扁平囊泡(saccule)由一組彎曲呈蹄鐵形的扁平囊泡組成,來源於核膜外層。彎曲的囊泡有兩個面(凸面和四面),凸面又稱形成面(forming face),或稱未成熟面(immatureface),靠近胞核;凹面為分泌面(secreting face),或稱成熟面(matureface),面向細胞膜。形成面的囊膜較薄,近似細胞膜。因此,高爾基囊泡可視為內質網膜與細胞膜的中間分化階段。
2、小泡(vesicle) 數量較多,與一般胞飲小泡相似,常散布於扁平囊泡的形成面,小泡由高爾基複合體附近的粗面內質網芽生而來,並載有粗面內質網所合成的蛋白質成分,後者被運送到高爾基複合體的囊泡形成面,在此,小泡與形成面的扁平囊泡膜融合,蛋白質乃進入囊泡腔中。
3、大泡(vacuole) 為扁平囊泡末端局部膨大而成,又稱分泌泡或濃縮泡,大泡帶著由扁平囊泡所生長的分泌物質(如脂蛋白、膽汁成分)斷離扁平囊泡,將其運往竇腔或排向毛細膽管。分泌面細胞膜周微絲、微管系統的存在,是這一功能得以實現的必要前提和保證。
小泡的併入及大泡的斷離,使高爾基囊膜不斷處於新陳代謝的動態變化之中。
常見的高爾基複合體病理改變為肥大或萎縮。高爾基複合體肥大多見於分泌障礙並伴有高爾基大泡內分泌物瀦留及淤膽等。膽汁成分瀦留於分泌泡中;在營養性或中毒性肝脂肪變時,脂蛋白瀦留於分泌囊泡中。高爾基複合體萎縮則常見於核蛋白體的合成功能下降狀態,如各種毒性因子造成的肝細胞蛋白合成降低時,即常見粗面內質網脫顆粒和斷裂。並伴有高爾基複合體的萎縮或消失。
微體
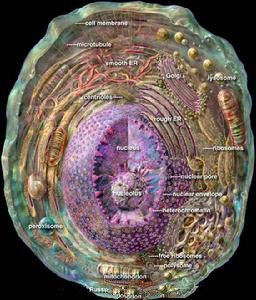 微體
微體過氧體來源於粗面內質網,形成迅速,從粗面內質網轉運出來大約只需一小時便可完成,在細胞內可存在5天,並在4分鐘內通過自噬或自溶過程而解體。亦有人認為,微體尚可合併到溶酶體或衍化成線粒體。從微體的發生及其所含酶的特點看,可視為一種特殊類型的溶酶體。從種系發生史上看,微體可被視為一種古老的氧化產能微器官的遺蹟,在細胞生物進化過程中逐漸被線粒體所取代。
微體內含有對長鏈脂酸進行β氧化降解的酶系,故能參與脂代謝。微體內的過氧化氫酶能降解細胞內的H2O2以防止氧化氫引起細胞中毒。微體內的過氧化氫酶和L-2-羥基酸氧化酶能將NADH再氧化,並通過過氧體的α-甘油磷酸脫氫酶,支持果糖的降解。因此,微體和線粒體是協同參與細胞呼吸的細胞器。
微體與微粒體(microsome)很易混淆,但這是兩個完全不同的概念。微體是細胞內固有的細胞器,而微粒體則系綴有大量核糖體的內質網碎片,是組織勻漿超速離心後的產物。在病理情況下,可見有肝細胞內微體數目的增多或減少。微體增多可由甲狀腺素引發,因而在甲狀腺功能亢進患者的肝細胞內,常見有微體數量的增多;反之,甲狀腺功能低下時,肝細胞內微體數目則減少。此外,慢性酒精中毒及肝癌時亦均見有肝細胞內微體數目的增多,其意義尚不清楚。
飲液泡
飲液泡具有吸收和輸送胞內物質的功能。
功能
肝細胞構成肝臟細胞總數的80%,是肝臟正常功能活動的物質基礎。肝細胞內代謝活躍,從血流中攝取經腸道消化吸收的物質,合成血漿蛋白的大部份,合成凝血因子、糖元、脂肪酸、膽固醇、磷脂等,並貯存糖元、蛋白質、脂類和維生素,以供機體需要;肝細胞同時還代謝外源性和內源性物質,如藥物、毒物、膽紅素、激素等;並製造和分泌膽汁參與消化過程。
相關疾病
肝細胞損害
肝細胞損害或稱肝細胞死亡,可分為凋亡和壞死,二者在形態、發生機制以及概念上都有很大的差別,是臨床常見的現象。無論發生於壞死或是凋亡時的致死性細胞的損害都是不可逆的過程。肝細胞壞死是指細胞漿膜不可逆的失去代謝功能和結構完整性的損害,其特點是漿膜失去完整性。肝細胞壞死多見於肝臟損傷性病變中,肝細胞嚴重水變性而高度腫脹,發生氣球樣變,進而細胞膜溶解和核破裂,核溶解。
肝細胞凋亡(apoptosis)為自身程控性細胞死亡,多屬於生理過程:肝細胞通過嗜酸性變而發生固縮,胞體變小,胞質變緻密,核濃縮以致消失,形成嗜酸性小體。這種死亡是主動的,耗能的單個細胞壞死,胞漿不呈現適應性反應。