簡介
 組蛋白
組蛋白組蛋白是是指所有真核生物的核中,與DNA結合存在的鹼性蛋白質的總稱。分子量約10000~20000。通常含有H1,H2A,H2B,H3,H4等5種成分。
親緣關係較遠的種屬中,四種組蛋白(H2A、H2A、H3、H4)胺基酸序列都非常相似,如海膽組織H3的胺基酸序列與來自小牛胸腺的H3的胺基酸序列間只有一個胺基酸的差異,小牛胸腺的H3的胺基酸序列與豌豆的H3也只有4個胺基酸不同。不同生物的H1序列變化較大,在某些組織中,H1被特殊的組蛋白所取代。如成熟的魚類和鳥類的紅細胞中H1則被H5所取代,精細胞中則由精蛋白代替組蛋白。染色質中的組蛋白與DNA的含量之比為1:1。
真核生物細胞核中組蛋白的含量約為每克DNA1克,大部分真核生物中有5種組蛋白,兩棲類、魚類和鳥類還有H5以替代或補充H1。
研究歷史
組蛋白於1834年由德國科學家A.科塞爾發現。早在1888年德國化學家科塞(A.Kossel)已從細胞核中分離出組蛋白,並認識到它們作為鹼性物質應在核中與核酸結合,但直到1974年才了解組蛋白的確切作用。一些實驗室隨後證明組蛋白以獨特的方式構成核小體的組分。
組蛋白是已知蛋白質中最保守的,例如,人類和豌豆的H4胺基酸序列只有兩個不同,人類和酵母的H4胺基酸序列也只有8個不同,這說明H4的胺基酸序列在約109年間幾乎是恆定的。
結構
 組蛋
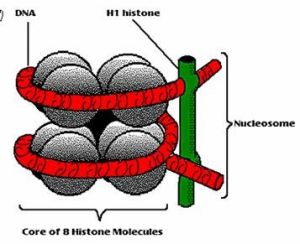
組蛋染色體是由重複單位──核小體組成。每一核小體包括一個核心8聚體(由4種核心組蛋白H2A、H2B、H3和H4的各兩個單體組成);長度約為200個鹼基對的脫氧核糖核酸(DNA);和一個單體組蛋白H1。長度約為140個鹼基對的DNA盤繞於核心8聚體外面。在核心8聚體之間則由長度約為60個鹼基對的DNA連線。這種DNA稱為“接頭”DNA。
命名分類
幾乎所有真核細胞染色體的組蛋白均可分成5種主要的組分,分別用字母或數字命名,命名方法也不統一,如H1或稱F1,Ⅰ;H2A或稱F2A2,Ⅱb1;H2B或稱F2B,Ⅱb2;H3或稱F3,Ⅲ;H4或稱F2A1,Ⅳ。有核的紅細胞或個別生物體中,還存在特別的組蛋白成分,紅細胞中為H5或F2C,Ⅴ,鮭魚組織中為H6或T。H2A、H2B、H3、H4組成核小體的核心,也稱核心組蛋白。
根據組蛋白的一級結構,又可將它們分為3種類型:賴氨酸含量特別豐富的組蛋白(H1);賴氨酸含量較豐富的組蛋白(H2A和H2B);精氨酸含量豐富的組蛋白(H3和H4)。
合成修飾
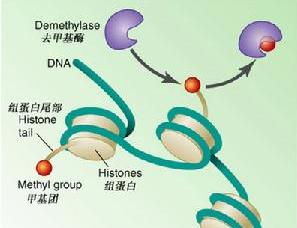
甲基化
 組蛋白修飾
組蛋白修飾組蛋白的甲基化修飾主要是由一類含有SET結構域的蛋白來執行的,組蛋白甲基化修飾參與異染色質形成、基因印記、X染色體失活和轉錄調控等多種主要生理功能,組蛋白的修飾作用是表觀遺傳學研究的一個重要領域。
組蛋白甲基化的異常與腫瘤發生等多種人類疾病相關,可以特異性地激活或者抑制基因的轉錄活性。研究發現,組蛋白甲基轉移酶的作用對象不僅僅限於組蛋白,某些非組蛋白也可以被組蛋白甲基轉移酶甲基化,這將為探明細胞內部基因轉錄、信號轉導、甚至個體的發育和分化機制提供更廣闊的空間。
乙醯化
乙醯化有兩種,一種是H1、H2A、H4組蛋白的氨基末端乙醯化,形成α-乙醯絲氨酸,組蛋白在細胞質內合成後輸入細胞核之前發生這一修飾。二是在H2A、H2B、H3、H4的氨基末端區域的某些專一位置形成N6-乙醯賴氨酸。
磷酸化
所有組蛋白的組分均能磷酸化,在細胞分裂期間,H1的1~3個絲氨酸可以磷酸化。而在有絲分裂時期,H1有3~6個絲氨酸或蘇氨酸發生磷酸化,其他四個核心組蛋白的磷酸化可以發生在氨基末端區域的絲氨酸殘基上。組蛋白的磷酸化可能會改變組蛋白與DNA的結合。
醫學套用
癌症診斷
球形組蛋白修飾模式可預測低分級前列腺癌的復發危。這種修飾模式最終可作為前列腺或其他類型癌症的預後或診斷指標,也可作為預測何種患者患者會對一類組蛋白去乙醯酶抑制劑新藥產生反應的指標。考慮到組蛋白修飾模式的多樣性,其他組蛋白修飾位點的信息將有助於我們對患者進行進一步分類,包括那些高分極組的患者。套用免役組化及越來越多的的抗體檢測組蛋白修飾將有助於這種檢測指標在其他腫瘤中的套用。
生物鐘的調控
組蛋白修飾與基因表達調控有關已經被廣泛的證明了。PierreEtchegary,StevenReppertandcoworkers的研究表明組蛋白修飾,特別是組蛋白乙醯化對於哺乳動物生物鐘的調控是非常重要的。