基本內容
概念
磷酸化(phosphorylation)是指在生物氧化中伴隨著ATP生成的作用。有代謝物連線的磷酸化和呼吸鏈連線的磷酸化兩種類型。即ATP生成方式有兩種。一種是代謝物脫氫後,分子內部能量重新分布,使無機磷酸酯化先形成一個高能中間代謝物,促使ADP變成ATP。這稱為底物水平磷酸化。如3-磷酸甘油醛氧化生成1,3-二磷酸甘油酸,再降解為3-磷酸甘油酸。另一種是在呼吸鏈電子傳遞過程中偶聯ATP的生成,這就是氧化磷酸化。生物體內95%的ATP來自這種方式。
偶聯部位
根據實驗測定氧的消耗量與ATP的生成數之間的關係以及計算氧化還原反應中ΔGO'和電極電位差ΔE的關係可以證明。
P/O比值是指代謝物氧化時每消耗1摩爾氧原子所消耗的無機磷原子的摩爾數,即合成ATP的摩爾數。實驗表明,NADH在呼吸鏈被氧化為水時的P/O值約等於2.5,即生成2.5分子ATP;氧化的P/O值約等於1.5,即生成1.5分子ATP。
氧-還電勢沿呼吸鏈的變化是每一步自由能變化的量度。根據ΔGO'= - nFΔE O'(n是電子傳遞數,F是法拉第常數),從NADH到Q段電位差約0.36V,從Q到Cytc為0.21V,從aa3到分子氧為0.53V,計算出相應的ΔGO'分別為69.5、40.5、102.3kJ/mol。於是普遍認為下述3個部位就是電子傳遞鏈中產生ATP的部位。
NADH→NADH脫氫酶→‖Q → 細胞色素bc1複合體→‖Cytc →aa3→‖O2
氧化磷酸化作用
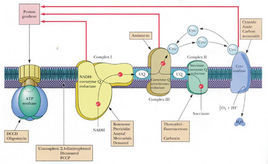
氧化磷酸化作用是指有機物包括糖、脂、胺基酸等在分解過程中的氧化步驟所釋放的能量,驅動ATP合成的過程。在真核細胞中,氧化磷酸化作用線上粒體中發生,參與氧化及磷酸化的體系以複合體的形式分布線上粒體的內膜上,構成呼吸鏈,也稱電子傳遞鏈。其功能是進行電子傳遞、H傳遞及氧的利用,產生HO和ATP
擴展:這種複合體一般有四個部分組成:複合體1.NADH-Q還原酶,複合體2.琥珀酸—Q還原酶.複合體3.細胞色素還原酶.4細胞色素氧化酶。
電子在電子載體的傳遞過程為:NADH或FADH --Q(泛醌)——細胞色素c——O(形成水和ATP的過程)。
電子和質子的轉移分子
電子傳遞鏈能承載質子和電子,將電子從供體轉移到受體,並在膜間搬運質子。這些過程會使用可溶性的蛋白質結合轉移分子。線上粒體中,電子在膜間隙內由水溶性電子傳遞蛋白細胞色素c傳遞。它通過其結構中血紅素基團的一個鐵原子的還原和氧化過程傳輸電子。在某些細菌的周質空間中也發現了細胞色素c。
線粒體內膜中的脂溶性電子載體輔酶Q10(Q)通過氧化還原循環,可同時攜帶電子和質子。這個小苯醌分子疏水性很強,所以它能自由地在膜中擴散。當Q接受兩個電子和兩個質子時,它被還原為“泛酚”形式(QH);當QH釋放兩個電子和兩個質子時,它被氧化為“泛醌”(Q)形式。結果,如果安排兩種酶,使得Q在膜的一側被還原,而QH在另一側被氧化,泛醌就能耦合這些反應,並攜帶質子穿過膜。除了泛醌,一些細菌在電子傳遞鏈中還使用其他的醌類,如甲萘醌。
在蛋白質中,電子在黃素輔因子、鐵硫簇和細胞色素之間轉移。有幾種類型的鐵硫簇化合物。在電子傳遞鏈中發現的最簡單的一種包含了由兩個無機硫原子連線的兩個鐵原子;這些稱為[2Fe-2S]簇。第二種稱為[4Fe-4S],包含了由四個鐵原子和四個硫原子組成的立方體。在這些簇中,每個鐵原子與一個額外的胺基酸配位,通常是半胱氨酸中的硫原子。金屬離子輔因子在氧化還原反應中不結合或釋放質子,因此在電子傳遞鏈中都只通過蛋白質傳輸電子。電子沿著這些輔因子鏈跳躍,在蛋白質中移動很長的距離。這些現象的本質是量子隧穿效應,在小於1.4×10米的距離內非常迅速。
真核生物的電子傳遞鏈
許多生化代謝過程,如糖酵解、三羧酸循環和β氧化,都會產生還原型輔酶NADH。此輔酶含有高電極電勢的電子;也就是說,它們將在氧化時釋放出大量的能量。然而,細胞不會一次性釋放完全部的能量,因為在這種情況下,反應將無法控制。相反,電子從NADH釋放出來,並通過一系列的酶傳遞給氧氣,其中每步只釋放少量的能量。由複合體I到IV組成的這組酶稱為電子傳遞鏈,存在於線粒體內膜中。琥珀酸也被電子傳遞鏈氧化,但起點不同。
真核生物中,電子傳遞系統中的酶用從氧化NADH釋放的能量,泵送質子穿過線粒體內膜。這會使質子在膜間隙中積聚,產生跨膜電化學梯度。然後,ATP合酶使用存儲在其中的勢能以產生ATP。其中,真核細胞線粒體中的氧化磷酸化是這一過程研究最為透徹的樣例。線粒體存在於幾乎所有的真核生物中,但部分原生生物例外,如陰道毛滴蟲中稱為氫化酶體的殘留線粒體會將質子還原為氫。
| 呼吸酶 | 氧化還原對 | 中點電位(伏) |
|---|---|---|
| NADH脫氫酶 | NAD / NADH | −0.32 |
| 琥珀酸脫氫酶 | FMN 或 FAD / FMNH 2 或FADH 2 | −0.20 |
| 細胞色素bc 1 複合體 | 輔酶Q10 ox / 輔酶Q10 red | +0.06 |
| 細胞色素bc 1 複合體 | 細胞色素b ox / 細胞色素b red | +0.12 |
| 複合體IV | 細胞色素c ox / 細胞色素c red | +0.22 |
| 複合體IV | 細胞色素a ox / 細胞色素a red | +0.29 |
| 複合體IV | O 2 / HO | +0.82 |
| 條件:pH = 7 | ||
NADH-輔酶Q氧化還原酶(複合體I)
NADH-Q還原酶,又稱“NADH脫氫酶”或“複合體I”,是電子傳遞鏈中的第一個蛋白。它是一個巨大的酶,在哺乳動物中該複合體由46亞基組成,有1000千道爾頓(kDa)。目前只了解一種細菌的複合體詳細結構;大多數生物的複合體酷似有一個大“球”的靴子,從膜中穿到線粒體。編碼單個蛋白質的基因同時包含在細胞核和線粒體基因組中,許多線粒體酶都是這種情況。
此酶催化的反應為NADH被輔酶Q10,即線粒體膜上的一種脂溶性醌類“泛醌”(在下面公式中寫作Q)所氧化,同時轉移兩個電子:
這個反應乃至於整個電子鏈,是從NADH分子與複合體I結合及放出兩個電子而開始。電子通過附著在其上的黃素單核苷酸(FMN)輔基進入複合體I。電子的加入使FMN轉換為它的還原形式,FMNH。電子隨後通過一系列存在於複合體中的第二種輔基鐵硫簇轉移。複合體I中存在兩種鐵硫簇,[2Fe-2S]和[4Fe-4S]。
電子穿過複合體時,有4個質子從基質泵入膜間隙。尚不清楚其中的機制,但似乎與複合體I的構象改變有關,這可使該蛋白質在膜的N側結合質子,並在P側釋放它們。最後,電子從鐵硫簇鏈轉移到膜中的泛醌分子上。泛醌的還原也有助於質子梯度的產生,因為基質中的兩個質子被用於泛酚(QH)的還原。
琥珀酸-Q氧化還原酶(複合體II)
琥珀酸-Q氧化還原酶,又稱“複合體II”或“琥珀酸脫氫酶”,是電子傳遞鏈的第二個入口。它很特別,因為它是唯一一個既屬於三羧酸循環、又屬於電子傳遞鏈的酶。複合體II包含四個蛋白質亞基,一個附著的黃素腺嘌呤二核苷酸(FAD)輔因子,鐵硫簇,和一個不參與將電子轉移到輔酶Q、但被認為在降低氧化物活性上起重要作用的血紅素基團。它將琥珀酸氧化為延胡索酸,將泛醌還原。該反應釋放的能量比氧化NADH少,因此複合體II不運輸質子穿過膜,不會影響質子梯度。
一些真核生物,如寄生蟲豬蛔蟲,有類似複合體II的延胡索酸還原酶(甲基萘醌:延胡索酸氧化還原酶,又稱QFR),但功能相反,其氧化泛醌而還原延胡索酸。這使蠕蟲可以在大腸的厭氧環境中生活,將延胡索酸作為電子受體進行厭氧氧化磷酸化。複合體II的另一種非常規功能在引起瘧疾的寄生蟲“惡性瘧原蟲”中得到體現。在這裡作為氧化酶,複合體II的逆作用對泛酚的再生很重要,寄生蟲將其用於一個不尋常的生物合成嘧啶的方式。
電子傳遞黃素蛋白-Q氧化還原酶
電子傳遞黃素蛋白-泛醌氧化還原酶(ETF-Q氧化還原酶),又稱“電子傳遞-黃素蛋白脫氫酶”,是電子傳遞鏈的第三個入口。它是接收線粒體基質中電子傳遞黃素蛋白的電子,並用這些電子還原泛醌的酶。這種酶包含一個黃素和一個[4Fe-4S]簇,但不像其它的呼吸鏈複合體,它只附著在膜的表面,不跨越脂質雙分子層。
哺乳動物中,該代謝途徑在脂肪酸的β氧化和胺基酸及膽鹼的分解代謝作用中很重要,因為它接受來自多個乙醯輔酶A脫氫酶的電子。在植物中,ETF-Q氧化還原酶也對使植物可以在長時間的黑暗中生存下來的代謝反應重要。
Q-細胞色素c氧化還原酶(複合體III)
Q-細胞色素c氧化還原酶又稱“細胞色素c還原酶”、“細胞色素bc複合體”,或簡稱“複合體III”。在哺乳動物中,這種酶是一個二聚體,每個亞基包含11個蛋白質亞基,1個[2Fe-2S]鐵硫簇和3個細胞色素:1個細胞色素c和2個細胞色素b。細胞色素是一種傳輸電子的蛋白,包含至少一個血紅素基團。當電子通過蛋白傳遞時,複合體III中血紅素基團內的鐵原子在還原型二價鐵(+2)和氧化型三價鐵(+3)之間切換。
複合體III催化的反應是一分子泛酚的氧化和兩分子細胞色素c的還原,血紅素蛋白部分與線粒體相關。不同於輔酶Q攜帶兩個電子,細胞色素c只攜帶一個電子。
作為反應中唯一可將電子從QH供體轉移到細胞色素c受體的物質,複合體Ⅲ的反應機理較其他呼吸複合物認識更為詳盡,其包含兩個步驟,稱作Q循環。首先在第一步中,酶與三個QH底物結合,然後將其氧化,並將所產生的一個電子傳遞到第二個底物細胞色素C。QH所釋放的兩個質子被傳遞到膜間隙。第三個底物Q接受來自QH的第二個電子,而還原為泛半醌自由基Q。先前的兩個底物被釋放,但這個泛半醌中間體仍然被酶所結合。第二步中,第二個QH分子與酶結合,再一次將它的第一個電子傳遞給細胞色素c受體。結合的泛半醌得到第二個電子,並獲得線粒體基質中的兩個質子,而還原為QH。這個QH隨後被酶釋放。
當輔酶Q在膜的內側還原為泛酚,而在另一面氧化為泛醌時,質子的跨膜淨轉移隨之發生,從而增加了質子梯度。通過相當複雜的兩步機制完成反應是重要的,因為它增加了質子轉移的效率。如果替換Q循環,直接用一個QH分子來還原兩個細胞色素c分子,則每還原一個細胞色素c只能傳送一個質子,效率將會減半。
細胞色素c氧化酶(複合體IV)
細胞色素c氧化酶,又稱“複合體IV”,是在電子傳遞鏈的最後一個蛋白質複合體。哺乳動物的酶有極其複雜的結構,包含13個亞基,2個血紅素基團,以及多種金屬離子輔因子——總計3個銅原子,1個鎂原子和1個鋅原子。
這種酶承載了電子傳遞鏈的最終反應,在跨膜泵送質子時將電子轉移到氧上。這一步,氧作為最終電子受體,也稱“末端電子受體”,被還原為水。直接泵送的質子和在氧的還原中消耗的基質中質子都能影響質子梯度。所催化的反應為細胞色素c的氧化及氧的還原:
替代的還原酶和氧化酶
許多真核生物的電子傳遞鏈中的酶與上述研究較多的哺乳動物有所不同。例如,植物有替代的NADH氧化酶,可以不線上粒體基質而在細胞質中氧化NADH,並將這些電子傳遞到泛醌池。這些酶不傳送子,可在不改變跨膜電化學梯度時還原泛醌。
分岔電子傳遞鏈的另一個例子是“替代氧化酶”,存在於植物、一些真菌及原生生物中,一些動物也可能包含其中。這種酶可直接將泛酚中的電子轉移到氧。
通過這些替代NADH和泛醌氧化酶的電子傳遞途徑比完整路徑的ATP產量低。這些捷徑的優點尚不明確。然而,替代氧化酶產生於應激反應,如受寒、活性氧、病原體感染,及其他抑制完整電子傳遞鏈的因素。因此,替代途徑可能可以通過減少氧化應激,從而提高生物對傷害的抵抗力。
複合體組織
最初的呼吸鏈複合體組織模型認為它們互相獨立,線上粒體膜中自由擴散。然而,最近的數據表明,複合體可能形成稱為超複合體或“呼吸體”的高級結構。在此模型中,各個複合體存在於有相互作用酶的有序集合中。這些關聯可能使各種酶複合體之間建立了底物通道,增加電子轉移的速率和效率。在哺乳動物的這些超複合體中,某些部件的數量可能較其它的要多,部分數據表明複合體I/II/III/IV和ATP合酶的比大致為1:1:3:7:4。然而,對超複合體假說的爭論仍未完全結束,因為部分數據似乎無法支持此模型。
原核生物的電子傳遞鏈
雖然結構和功能與真核生物中的電子傳遞鏈相似,細菌和古菌的電子傳遞酶種類更為繁多。它們也擁有種類同樣繁多的化學物質作為底物。與真核生物相同,原核生物的電子傳遞使用氧化底物所釋放的能量泵送離子跨膜,以產生電化學梯度。細菌中,對大腸桿菌的氧化磷酸化最為了解,而古菌中的這個過程目前仍知之甚少。
真核生物和原核生物氧化磷酸化過程的主要區別是,細菌和古菌使用許多不同的物質以提供或接受電子。這使得原核生物可以在各種環境中生活。例如在大腸桿菌中,許多還原劑和氧化劑對都可以驅動氧化磷酸化,如下所示。化學物質的中點電位可以衡量其被氧化或還原時所釋放的能量,其中還原劑具有負電位,氧化劑具有正電位。
| 呼吸酶 | 氧化還原對 | 中點電位(伏) |
|---|---|---|
| 甲酸脫氫酶 | 碳酸氫鹽 /甲酸鹽 | −0.43 |
| 氫化酶 | 質子 / 氫 | −0.42 |
| NADH脫氫酶 | NAD / NADH | −0.32 |
| 甘油-3-磷酸脫氫酶 | DHAP/Gly-3-P | −0.19 |
| 丙酮酸氧化酶 | 醋酸鹽 +二氧化碳/ 丙酮酸鹽 | ? |
| 乳酸脫氫酶 | 丙酮酸鹽 /乳酸鹽 | −0.19 |
| D-胺基酸脫氫酶 | 2-含氧酸+ 氨 /D-胺基酸 | ? |
| 葡萄糖脫氫酶 | 葡萄糖酸鹽/葡萄糖 | −0.14 |
| 琥珀酸脫氫酶 | 延胡索酸鹽 / 琥珀酸鹽 | +0.03 |
| 泛酚氧化酶 | 氧 / 水 | +0.82 |
| 硝酸鹽還原酶 | 硝酸鹽 / 亞硝酸鹽 | +0.42 |
| 亞硝酸鹽還原酶 | 亞硝酸鹽 / 氨 | +0.36 |
| 二甲基亞碸還原酶 | DMSO / DMS | +0.16 |
| 氧化三甲胺還原酶 | TMAO / TMA | +0.13 |
| 延胡索酸還原酶 | 延胡索酸鹽 / 琥珀酸鹽 | +0.03 |
如上所示,大腸桿菌可以在有還原劑如甲酸鹽、氫或乳酸作為電子供體,及硝酸鹽、DMSO、或氧氣作為受體的條件下生活。氧化劑和還原劑之間的中點電位差異越大,它們發生反應時就能釋放更多的能量。這些化合物中,琥珀酸鹽/延胡索酸鹽對較特別,因為它的中點電位接近於零。琥珀酸鹽因此可以在有強氧化劑的條件下氧化成延胡索酸鹽,如氧,或者延胡索酸鹽在有強還原劑的條件下還原成琥珀酸鹽,如甲酸鹽。這些替代反應分別由琥珀酸脫氫酶和延胡索酸還原酶催化。
一些原核生物使用較小中間電位差的氧化還原對。例如,硝化細菌如硝化桿菌將亞硝酸鹽氧化為硝酸鹽,將電子傳給氧氣。反應中釋放的少量能量就足以泵送質子以產生ATP,但還不足以直接產生同化作用所需的NADH或NADPH。通過使用亞硝酸鹽還原酶產生足夠的質子動力,讓電子傳遞鏈的一部分反向運行,使複合體I生成NADH,從而解決了此問題。
原核生物可變換其產生的酶,控制電子供體和受體的使用,以適應環境條件的改變。 因為不同的氧化酶和還原酶都使用相同的泛醌池,使其有一定的靈活性。由共同的泛醌中間體建立聯繫,酶的不同組合可以一起發揮作用。呼吸鏈的模組化設計使其擁有多套可交換的酶系統。
除了代謝的多樣性,原核生物也具有一系列的同工酶——可催化相同反應的不同酶。例如大腸桿菌有兩種不同類型的泛酚氧化酶,都用氧作為電子受體。在氧充足的條件下,細菌會使用氧親和性較低的氧化酶,其中每個電子可運送兩個質子。但如果氧含量下降,它就能換用每個電子只能運送一個質子,但對氧有高親合性的氧化酶。
胞液中NADH的氧化
 氧化磷酸化
氧化磷酸化糖代謝中的三羧酸循環和脂肪酸β-氧化是線上粒體內生成NADH(還原當量),可立即通過電子傳遞鏈進行氧化磷酸化。在細胞的胞漿中產生的NADH ,如糖酵解生成的NADH則要通過穿梭系統(shuttle system)使NADH的氫進入線粒體內膜氧化。
(一)α-磷酸甘油穿梭作用
這種作用主要存在於腦、骨骼肌中,載體是α-磷酸甘油。
胞液中的NADH在α-磷酸甘油脫氫酶的催化下,使磷酸二羥丙酮還原為α-磷酸甘油,後者通過線粒體內膜,並被內膜上的α-磷酸甘油脫氫酶(以FAD為輔基)催化重新生成磷酸二羥丙酮和FADH2,後者進入琥珀酸氧化呼吸鏈。葡萄糖在這些組織中徹底氧化生成的ATP比其他組織要少,1摩爾G→36摩爾ATP。
(二)蘋果酸-天冬氨酸穿梭作用
主要存在肝和心肌中。1摩爾G→38摩爾ATP
胞液中的NADH在蘋果酸脫氫酶催化下,使草醯乙酸還原成蘋果酸,後者藉助內膜上的α-酮戊二酸載體進入線粒體,又線上粒體內蘋果酸脫氫酶的催化下重新生成草醯乙酸和NADH。NADH進入NADH氧化呼吸鏈,生成3分子ATP。草醯乙酸經穀草轉氨酶催化生成天冬氨酸,後者再經酸性胺基酸載體轉運出線粒體轉變成草醯乙酸。
偶在線上制
化學滲透假說
(chemiosmotic hypothesis)
1961年,英國學者Peter Mitchell提出化學滲透假說(1978年獲諾貝爾化學獎),說明了電子傳遞釋出的能量用於形成一種跨線粒體內膜的質子梯度(H+梯度),這種梯度驅動ATP的合成。這一過程概括如下:
1.NADH的氧化,其電子沿呼吸鏈的傳遞,造成H 被3個H 泵,即NADH脫氫酶、細胞色素bc1複合體和細胞色素氧化酶從線粒體基質跨過內膜泵入膜間隙。
2.H 泵出,在膜間隙產生一高的H+ 濃度,這不僅使膜外側的pH較內側低(形成pH梯度),而且使原有的外正內負的跨膜電位增高,由此形成的電化學質子梯度成為質子動力,是H+ 的化學梯度和膜電勢的總和。
3.H 通過ATP合酶流回到線粒體基質,質子動力驅動ATP合酶合成ATP。
ATP合酶
ATP合酶由兩部分組成(Fo-F1),球狀的頭部F1突向基質液,水溶性。亞單位Fo埋在內膜的底部,是疏水性蛋白,構成H+ 通道。在生理條件下,H+ 只能從膜外側流向基質,通道的開關受柄部某種蛋白質的調節。
ATP合酶,又稱“複合體V”,是氧化磷酸化途徑中的終點酶。無論在原核生物還是真核生物中,這種酶的形式和作用方式都相同。它用存儲在跨膜質子梯度的能量,驅動ADP和磷酸鹽(P)合成ATP。合成一個ATP分子所需的質子數估計為為3至4個,有人認為細胞可以調節這一比例以適應不同的條件。
這個磷酸化反應是個可逆反應,可以通過改變質子動力變換反應方向。在不存在質子動力時,ATP合酶的反應將向左運行,水解ATP及將質子從基質中跨膜泵出。然而當存在高質子動力時,反應將被強制反向進行;反應從左向右進行,允許質子順濃度梯度流下,將ADP轉化為ATP。事實上,與此密切相關的液泡型H +-ATP酶可通過泵送質子和水解ATP,從而酸化細胞區室。
ATP合酶是一個巨大的蛋白質複合體,呈蘑菇狀。哺乳動物的酶複合體包含16個亞基,質量約為600千道爾頓。嵌入在膜中的部分稱為F,包含一個c亞基環和質子通道。柄和球形頭部稱為F,是ATP的合成位點。F端部的球形複合體包含兩種不同的六個蛋白(3個α亞基和3個β亞基),而“柄”包括一個蛋白:γ亞基,柄的前端延伸到球的α和β亞基。α和β亞基都可與核苷酸結合,但只有β亞基可催化ATP的合成反應。與F部分的一側接觸並延伸到膜背面的是一個長桿狀的亞基,將α和β亞基固定在酶的基底上。
當質子穿過ATP合酶基底的通道跨膜時,F上的質子驅動馬達隨之鏇轉。轉動的原因可能是由於c亞基環上的胺基酸電離變化,引起靜電相互作用,從而推動c亞基環鏇轉。鏇轉的環反過來驅動α和β亞基內的中心軸(γ亞基柄)鏇轉。作為定子的α和β亞基被側臂固定以防止自身發生鏇轉。在由α和β亞基組成的球內,γ亞基頂部的運動為β亞基的活性部位提供了能量,使其周期性地產生並釋放ATP。
此ATP的合成反應稱為結合能力機制,其中涉及β亞基活性位點在三種狀態之間的循環。在“空置”態,ADP和磷酸根進入活性位點(圖中棕色所示)。然後蛋白質包圍這些分子,並與之鬆散結合——是為“疏鬆結合”態(紅色所示)。隨後,酶再次改變形狀,迫使這些分子結合在一起,在隨後的“緊密結合”態(粉色所示)中,活性位點與新產生的極高親和力ATP分子結合。最後,活性位點循環回空置態,釋放出ATP並再次結合ADP和磷酸根,準備下一個循環。
在一些細菌和古菌中,ATP的合成是由鈉離子的跨細胞膜移動所驅動,而不是質子的移動。古菌如甲烷球菌也包含AA合酶,其包含額外的蛋白質,亞基順序與其他細菌和真核生物ATP合酶不相類似。也許在一些物種中,AA的酶是一種特殊的鈉驅動ATP合酶,但可能在其他情況下並不總是正確的。
活性氧物質
氧分子是強氧化劑,因而是一種理想的末端電子受體。但氧的還原過程涉及有潛在危害的中間體。雖然四個電子和四個質子的轉移而將氧還原為水的反應是無害的,一個或兩個電子的轉移會產生超氧或過氧陰離子,這是危險的反應。
這些活性氧和它們的反應產物,如羥基自由基,對細胞非常有害,因為它們能氧化蛋白質並導致DNA突變。細胞的損傷可能會誘發疾病,並可能是導致老化的原因之一。
細胞色素c氧化酶複合體能高效地將氧還原為水,且只釋放極少量的部分還原中間體;然而,電子傳遞鏈卻會產生少量的超氧陰離子和過氧化物。其中尤為重要的是輔酶Q在複合體III中的還原過程,因為作為一種中間體,高活性的泛半醌自由基會在Q循環中生成。這種不穩定的物質可能會導致電子的“泄漏”,從而直接將電子傳遞到氧,形成超氧化物。由於在高膜電位時,這些質子泵複合物生成活性氧物質的速度最快,有人認為線粒體能調節自己的活動,使膜電位維持在一個狹窄的範圍內,以此平衡氧化劑和ATP的生成。例如,氧化劑可以激活解偶聯蛋白,從而降低膜電位。
為了清除活性氧,細胞有一套複雜的抗氧化劑體系,包括抗氧化維生素如維生素C和維生素E,抗氧化酶如超氧化物歧化酶、過氧化氫酶和過氧化物酶,它們能消除活性物質的毒性,減小對細胞的損傷。
影響因素
抑制劑
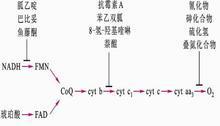
能阻斷呼吸鏈某一部位電子傳遞的物質稱為呼吸鏈抑制劑。
魚藤酮、安密妥(或阿米妥)在NADH脫氫酶處抑制電子傳遞,阻斷NADH的氧化,但FADH的氧化仍然能進行。
抗黴素A抑制電子在細胞色素bc1複合體處的傳遞。
氰化物、CO、疊氮化物(N3-)抑制細胞色素氧化酶。
對電子傳遞及ADP磷酸化均有抑制作用的物質稱氧化磷酸化抑制劑,如寡黴素。
已知的電子傳遞鏈抑制劑及抑制部位如下:
作用物→NAD→〈FMN(Fe-S)〉→CoQ→Cytb→Cytc1→Cytc→Cytaa3→O
......................................................↑...................↑.....................................↑
............................................安密妥.魚藤酮.....抗黴素...........................CO.CN-
| 化合物 | 作為 | 效果 |
|---|---|---|
| 氰化物 一氧化碳 疊氮化物 硫化氫 | 毒素 | 能比氧更強烈地結合細胞色素c氧化酶的 鐵 銅中心,阻止氧的還原,從而抑制電子傳遞鏈。 |
| 寡黴素 | 抗生素 | 阻止質子流過F o 亞基,從而抑制ATP合酶。 |
| FCCP 2,4-二硝基苯酚 | 毒素 | 攜帶質子跨膜的離子載體,從而破壞質子梯度。這種離子載體將質子泵與ATP合酶解耦,因為它能承載質子跨過線粒體內膜。 |
| 魚藤酮 | 農藥 | 阻斷與泛醌結合的位點,從而阻止電子從複合體I轉移到泛醌。 |
| 丙二酸鹽和草醯乙酸 | 琥珀酸脫氫酶(複合體II)的競爭性抑制劑。 |
解偶聯劑
2,4-二硝基苯酚(DNP)和頡氨黴素可解除氧化和磷酸化的偶聯過程,使電子傳遞照常進行而不生成ATP。DNP的作用機制是作為H的載體將其運回線粒體內部,破壞質子梯度的形成。由電子傳遞產生的能量以熱被釋出。
ADP的調節作用
正常機體氧化磷酸化的速率主要受ADP水平的調節,只有ADP被磷酸化形成ATP,電子才通過呼吸鏈流向氧。如果提供ADP,隨著ADP的濃度下降,電子傳遞進行,ATP在合成,但電子傳遞隨ADP濃度的下降而減緩。此過程稱為呼吸控制,這保證電子流只在需要ATP合成時發生。
歷史
對氧化磷酸化的研究起源於阿瑟·哈登1906年的報告,闡述了磷酸鹽在細胞發酵中的重要作用,但最初只知道糖磷酸鹽與此相關。然而在20世紀40年代初,糖的氧化和ATP的生成之間的聯繫被赫爾曼·卡爾卡牢牢確立,同時在1941年,弗里茨·阿爾伯特·李普曼確認ATP在能量傳遞中起核心作用。後來在1949年,莫里斯·弗里德金與阿爾伯特·倫寧格證明,輔酶NADH與代謝途徑如三羧酸循環及ATP的合成有關。
又過了二十年,ATP的生成機制依然是個謎,同時科學家也在尋找那個難以捉摸的連線氧化與磷酸化反應的“高能中間體”。這個難題在彼得·米切爾於1961年發表的化學滲透理論中得到了解決。起初,這個看法極具爭議,但隨時間流逝,它逐漸為人們所接受,米切爾也於1978年獲頒諾貝爾物理學獎。隨後的研究集中於提純和描述所涉及的酶,其中戴維·格林和埃夫拉伊姆·萊克分別對電子傳遞鏈上複合體和ATP合酶的研究作出了重大貢獻。解決ATP合酶機制的關鍵步驟由保羅·博耶1973年構想的“結合變構”機制所解釋,隨後是1982年他提出的鏇轉催化的激進想法。較近期的工作包括由約翰·沃克完成的氧化磷酸化酶的結構研究。沃克和博耶於1997年被授予諾貝爾化學獎。