簡介
 甲烷分子結構示意圖
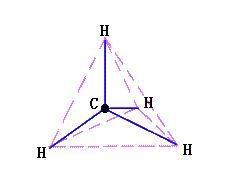
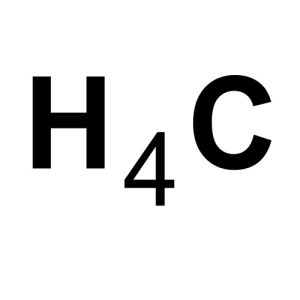
甲烷分子結構示意圖甲烷,化學式CH4,是最簡單的烴(tīng,碳氫化合物),分子是正四面體空間構型,C—H鍵能413kJ/mol,H—C—H鍵角109°28′。甲烷的結構式只是表示分子裡各原子的連線情況,並不能真實表示各原子的空間相對位置。
在標準狀態下甲烷是一種無色、可燃、無毒的氣體。甲烷在自然界分布很廣,是天然氣、沼氣、坑氣及煤氣的主要成分之一。它可用作燃料及製造氫、一氧化碳、炭黑、乙炔、氫氰酸及甲醛等物質的原料。
含量分布
天王星的大氣層也存在甲烷和氫氣。據德國核物理研究所的科學家經過試驗發現,植物和落葉都產生甲烷,而生成量隨著溫度和日照的增強而增加。另外,植物產生的甲烷是腐爛植物的10到100倍。他們經過估算認為,植物每年產生的甲烷占到世界甲烷生成量的10%到30%。行星中發現甲烷據國外媒體報導,美國天文學家19日宣布,他們首次在太陽系外一顆行星的大氣中發現了甲烷,這是科學家首次在太陽系外行星探測到有機分子,從而增加了確認太陽系外存在生命的希望。該小組還證實了先前的猜測,即這顆名叫HD189733b的行星的大氣中有水。
甲烷是創造適合生命存在的條件中,扮演重要角色的有機分子。美國宇航局噴氣推進實驗室的天文學家,利用繞軌運行的“哈勃”太空望遠鏡得到了一張行星大氣的紅外線分光鏡圖譜,並發現了其中的甲烷痕跡。
行星HD189733b位於狐狸座,距地球63光年,是一類叫做“熱木星”大行星,其表面灼熱,不可能存在液態水。HD189733b圍繞其恆星轉一圈只需兩天。由於距離恆星太近,這顆行星表面溫度高達900℃(1650華氏度),足以把銀子熔化。
不過,值得注意的是探測到甲烷。這種方法可以沿用到環繞所謂的“可居住區”(GoldilocksZone)中溫度較低的恆星運轉的其它行星,“可居住區”不冷也不熱,正好適合孕育生命
物理性質
蒸汽壓53.32kPa/-168.8℃
 甲烷分子結構圖
甲烷分子結構圖 飽和蒸氣壓(kPa):53.32(-168.8℃)
相對蒸氣密度(空氣=1):0.55
燃燒熱:890.31KJ/mol
總發熱量:55900kJ/kg(40020kJ/m3)
淨熱值:50200kJ/kg(35900kJ/m3)
臨界溫度(℃):-82.6
臨界壓力(MPa):4.59
爆炸上限%(V/V):15
爆炸下限%(V/V):5.3
引燃溫度(℃):538
分子直徑:0.414nm
化學性質
甲烷化學性質比較穩定,把製得的甲烷氣體通入盛有高錳酸鉀溶液(加幾滴稀硫酸)的試管里,沒有變化。再把甲烷氣體通入溴水,溴水不褪色。
取代反應
把一個大試管分成五等份,或用一支有刻度的量氣管,用排飽和食鹽水法先收集1/5體積的甲烷,再收集4/5體積的氯氣,把它固定在鐵架台的鐵夾上,並讓管口浸沒的食鹽水裡。然後讓裝置受漫射光照射。在陽光好的日子,約半小時後可以看到試管內氯氣的黃綠色逐漸變淡,管壁上出現油狀物,這是甲烷和氯氣反應的所生成的一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和少量的乙烷的混合物。試管中液面上升,這是反應中生成的氯化氫溶於水的緣故。食鹽水中白色晶體析出。因為氯氣極易溶於水,溶於水後增加了水中氯離子的濃度,是氯化鈉晶體析出。用大拇指按住試管管口,提出液面,管口向上,向試管中滴入紫色石蕊試液或鋅粒,可驗證它是稀鹽酸。如果在陰暗的天氣需1到2小時才能觀察到反應的結果。
CH4+Cl2→(光照)CH3Cl+HCl
CH3Cl+Cl2→(光照)CH2Cl2+HCl
CH2Cl2+Cl2→(光照)CHCl3+HCl
CHCl3+Cl2→(光照)CCl4+HCl
氧化反應
點燃純淨的甲烷,在火焰的上方罩一個乾燥的燒杯,很快就可以看到有水蒸氣在燒杯壁上凝結。倒轉燒杯,加入少量澄清石灰水,振盪,石灰水變渾濁。說明甲烷燃燒生成水和二氧化碳。把甲烷氣體收集在高玻璃筒內,直立在桌上,移去玻璃片,迅速把放有燃燒著的蠟燭的燃燒匙伸入筒內,燭火立即熄滅,但瓶口有甲烷在燃燒,發出淡藍色的火焰。這說明甲烷可以在空氣里安靜地燃燒,但不助燃。用大試管以排水法先從氧氣貯氣瓶里輸入氧氣2/3體積,然後再通入1/3體積的甲烷。用橡皮塞塞好,取出水面。將試管顛倒數次,使氣體充分混和。用布把試管外面包好,使試管口稍微下傾,拔去塞子,迅速用燃著的小木條在試管口引火,即有尖銳的爆鳴聲發生。這個實驗雖然簡單,但也容易失敗。把玻璃導管口放出的甲烷點燃,把它放入貯滿氯氣的瓶中,甲烷將繼續燃燒,發出紅黃色的火焰,同時看到有黑煙和白霧。黑煙是炭黑,白霧是氯化氫氣體和水蒸氣形成的鹽酸霧滴。
CH4+2O2=點燃=CO2+2H2O
CH4+2Cl2=點燃=C+4HCl
加熱分解
用125毫升集氣瓶,收集一瓶純淨的甲烷。集氣瓶口配有穿過兩根粗銅電極(在瓶內約為瓶高的二分之一處)和直角玻管的橡皮塞,塞緊(如有孔隙,可塗上一薄層熔化的石蠟),並與盛有溴水的洗氣瓶連線(由於反應過程中會有一定量乙炔氣體生成)。電極通過感應圈與電源相連。實驗時,先放鬆導管上的夾子,接通6伏電源,銅電極間發生電火花放電,瓶壁上可以看到有炭黑產生,說明甲烷已經分解。稍等片刻,在導管的尖嘴處點火,並用於冷的燒杯罩在火焰上方,可以看到燒杯內壁變得模糊,並有水蒸氣凝結,說明有氫氣生成。
來源
 甲烷
甲烷工業來源
工業用甲烷主要來自天然氣、烴類裂解氣、煉焦時副產的焦爐煤氣及煉油時副產的煉廠氣,煤氣化產生的煤氣也提供一定量的甲烷。生物分解
植物和落葉都產生甲烷,而生成量隨著溫度和日照的增強而增加。另外,植物產生的甲烷是腐爛植物的10到100倍。經過估算認為,植物每年產生的甲烷占到世界甲烷生成量的10%到30%。
有機物在無氧環境中,經腐敗菌分解後,再經甲烷菌作用,即有甲烷生成。如纖維素在湖沼污泥中腐敗分解生成的脂肪酸、醇,以及共存的二氧化碳和氫等,都能在甲烷菌作用下最終生成甲烷。其生成反應中較主要的有:
CH3COOH─→CH4+CO2
4CH3OH─→3CH4+CO2+2H2O
CO2+4H2─→CH4+2H2O
化學合成
將二氧化碳與氫在催化劑作用下,生成甲烷和氧,再提純。CO2+2H2=CH4+O2
將碳蒸汽直接與氫反應,同樣可製得高純的甲烷。
無水醋酸鈉(CH3COONa)和鹼石灰(NaOH和CaO做乾燥劑)反應:CH3COONa+NaOH===Na2CO3+CH4↑ 收集:排水法或向下排空氣法。
危害
甲烷對人基本無毒,但濃度過高時,空氣中氧含量明顯降低,使人窒息。
當空氣中甲烷達25%~30%時,可引起頭痛、頭暈、乏力、注意力不集中、呼吸和心跳加速、共濟失調。若不及時脫離,可致窒息死亡。
皮膚接觸液化甲烷,可致凍傷。
危險性
易燃,與空氣混合能形成爆炸性混合物,遇熱源和明火有燃燒爆炸的危險。與五氧化溴、氯氣、次氯酸、三氟化氮、液氧、二氟化氧及其他強氧化劑接觸劇烈反應。
應急處理
泄漏應急處理
迅速撤離泄漏污染區人員至上風處,並進行隔離,嚴格限制出入。切斷火源。建議應急處理人員戴自給正壓式呼吸器,穿消防防護服。儘可能切斷泄漏源。合理通風,加速擴散。噴霧狀水稀釋、溶解。構築圍堤或挖坑收容產生的大量廢水。如有可能,將漏出氣用排風機送至空曠地方或裝設適當噴頭燒掉。也可以將漏氣的容器移至空曠處,注意通風。漏氣容器要妥善處理,修復、檢驗後再用。
防護措施
呼吸系統防護:一般不需要特殊防護,但建議特殊情況下,佩帶自吸過濾式防毒面具(半面罩)。
眼睛防護:一般不需要特別防護,高濃度接觸時可戴安全防護眼鏡。
身體防護:穿防靜電工作服。
手防護:戴一般作業防護手套。
其他:工作現場嚴禁吸菸。避免長期反覆接觸。進入罐、限制性空間或其它高濃度區作業,須有人監護。
急救措施
皮膚接觸:若有凍傷,就醫治療。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
滅火方法:切斷氣源。若不能立即切斷氣源,則不允許熄滅正在燃燒的氣體。噴水冷卻容器,可能的話將容器從火場移至空曠處。滅火劑:霧狀水、泡沫、二氧化碳、乾粉。
用途
用作燃料
以甲烷為主要成分的天然氣,用作優質氣體燃料,已有悠久的歷史。現代化的勘探、采輸技術促進了天然氣的大規模利用,使之成為世界第三能源。已開發國家已大規模鋪設天然氣輸氣管網,將天然氣用作城市煤氣。天然氣加壓液化所得的液化天然氣,熱值比航空煤油高15%,用於汽車、海上快艇和超音速飛機,不但能提高速度,而且可節省燃料消耗。
用作化工原料
富含甲烷的乾性或濕性天然氣中的甲烷組分,是生產一系列化工產品的重要原料。現代的天然氣化工,其主要內容就是甲烷的化工利用。甲烷經蒸汽轉化可製得合成氣;經熱裂解可生產乙炔或炭黑;經氯化可製得甲烷氯化物;經硫化可製得二硫化碳;經硝化可製得硝基烷烴;加氨氧化可製得氫氰酸;直接催化氧化可得甲醛。
高純甲烷可用於非晶矽太陽電池製造,用於大規模積體電路乾法刻蝕或等離子刻蝕氣的輔助添加氣。也是製造氨、炭黑、甲基化合物、二硫化碳、氫氰酸等的原料。
生物化學術語(一)
| 我們學習了很多的生物化學的專業術語。現在,我把它們都整理在一起,可以使我們更加全面、完整的學習,認識,了解它們。 |