電極介紹
電池 的組成部分,它由一連串相互接觸的物相構成,其一端是電子導體──金屬(包括石墨)或半導體 ,另一端必須是離子導體──電解質(這裡專指電解質溶液,簡稱“電解液”或“電液”)。結構最簡單的電極應包括兩個物相和一個相界面,即〔金屬|電液〕。上述定義的電極也稱“半電池”。電極的概念是M.法拉第 進行系統電解實驗後在1834年提出的,原意只指構成電池的插在電液中的金屬 棒。電極表達式
書刊上表達電極的方式很不一致,這裡採用的方式是:寫下各串聯的物相,每一相界面用一個隔離線表示。如銅電極寫成Cu|CuSO4(1Μ,水溶液)或Cu|Cu;甘汞電極寫成Hg|Hg2Cl2|Cl;在水溶液中的鈍化的鐵電極可寫成Fe|Fe3O4|Fe2O3|水溶液。電極方塊圖把電極的各個相用分隔的方塊表達,便於標明各相界面上的反應,有助於理解電極上發生的實際過程。
電極的命名
命名方式很複雜,有些根據電極的金屬部分命名,如銅電極、鉑電極等;有些根據電極活性的氧化還原對中的特徵物質命名,如甘汞電極、氫電極;有些根據電極金屬部分的形狀命名,如滴汞電極、轉盤電極;有些根據電極的功能命名。這些名稱如參比電極、鈉離子選擇電極(見離子選擇性電極)等,都是約定俗成的。
電極分類
按材料分
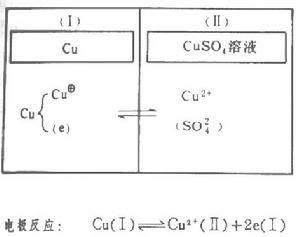 銅電極
銅電極1.金屬電極,如銅電極(如右圖),其特點是氧化還原對可以遷越相界面。
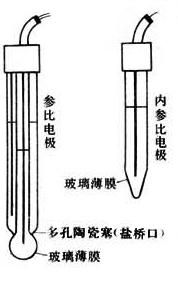 膜電極
膜電極2.膜電極: 利用隔膜對於單種離子的透過性或膜表面與電解液的離子交換平衡所建立的電勢來測量電液中特定離子活度的裝置(如右下圖),例如玻璃電極、離子選擇性電極。
3. 微電極:工作面積很小的電極。電極面積大小的界限並不十分嚴格。微電極包括兩種涵義:①指電極的微型化。②指在電化學分析中電極面積很小但整個電極並非微型化的一類電極。
4.化學修飾電極:利用吸附、塗敷、聚合、化學反應等方法把活性基團、催化物質等附著在電極金屬(包括石墨、半導體)表面上,使之具有較強的特徵功能。這是70年代以來電極製備方法的新發展。
5.氣體電極,是氧化還原對的一個組分為氣體時的氧化還原電極,例如氫電極(Pt|H2|H)、氯電極(Pt|Cl2|Cl)等。為了加速達成平衡,金屬鉑上需要鍍上鉑黑以增加表面積並起電催化作用。
6.難溶鹽電極,氧化還原對的一個組分是難溶鹽或其他固相。因此它包含三個物相、兩個界面,在每一相界面上存在著單一的快速遷越過程,如甘汞電極(Hg|Hg2Cl2|Cl)、氧化汞電極(Hg|HgO|OH)。在甘汞電極中,甘汞與電解液的溶解平衡完全受電液中濃度較高的Cl所控制,Cl在Hg2Cl2|電液界面上的交換速率也很快,故它的電極電勢非常穩定。它是最常用的參比電極,有些書刊稱這類電極為第二類電極。
按作用分
1.指示電極: 是指對溶液中參與半反應的離子的活度或不同氧化態的離子的活度能產生能斯特回響的電極。是電化學分析法中所用的工作電極。它和另一對應電極或參比電極組成電池,通過測定電池的電動勢或在外加電壓的情況下測定流過電解池的電流,即可得知溶液中某種離子的濃度。根據功能不同,指示電極可分為電勢型和電流型兩大類。屬於電勢型的有電位法和電位滴定法中所用的各種電極,其中常用的是各類離子選擇性電極。在電位法中,利用測定電池的電動勢,即可由能斯特公式推知在指示電極上發生反應的離子濃度。屬於電流型的有極譜法和伏安法或安培滴定法中所用的滴汞電極和各種固體微電極以及庫侖滴定中所用的鉑電極等。在極譜法和伏安法中,由於指示電極面積極小,電極反應時發生極化作用,由微電極指示出的擴散電流和離子濃度的線性關係即可測知溶液中離子的濃度。
2.工作電極 :工作電極是指在測試過程中可引起試液中待測組分濃度明顯變化的電極,如電解和庫侖分析法中的鉑電極。
3.參比電極: 電位具有穩定性和重現性的電極。可以用它作為基準來測量其他電極的電位。常用的參比電極有氫電極、甘汞電極、銀|氯化銀電極、汞|氧化汞電極、汞|硫酸亞汞電極。
4.輔助電極:也叫對電極,它只用來通過電流以實現研究電極的極化。研究陰極過程時,輔助電極作陽極,而研究陽極過程時,輔助電極作陰極。輔助電極的面積一般比研究電極大,這樣就降低了輔助電極上的電流密度,使其在測量過程中基本上不被極化,因而常用鉑黑電極作輔助電極,也可以使用在研究介質中保持惰性的金屬材料如Ag、Ni、W、Pb等;在特定情況下有時使用特定電極。有時為了測量簡便,輔助電極也可以用與研究電極相同的金屬製作。
按性質分
1.極化電極:在可逆電池的情況下,整個電池處於電化學平衡狀態,兩個電極也分別處於平衡狀態,電極電位是由能斯特方程決定的,是平衡的電極電位。此時,通過電極的電流為零,即電極反應的速率為零。若要使一個不為零的電流通過電極,電極電位必須偏離平衡電極電位的值,這個就稱為極化電極。
2.去極化電極:電極電位在電解過程中保持恆定,不隨外加電壓的變化而改變,這樣的電極成為去極化電極。
按發生電化學反應的數目分
1.單一電極:如果電極的金屬│電液界面上只存在一種起主導作用的電極反應,這就是單一電極
2.多重電極:如果存在的不只是一種電極反應,就是多重電極。例如鋅電極(Zn|ZnSO4水溶液)上可能存在兩種電極反應:
Zn─→Zn+2e (1)
2H+2e─→H2 (2)
但由於金屬鋅上的氫超電勢很高,反應(2)速率太小,反應(1)是主導的,上述鋅電極被認為是單一電極,是典型的可逆電極。當不太純的鋅浸入硫酸中時,反應(1)和(2)的速率都較快,所以【Zn|H2SO4】電極是二重電極,它的靜態電勢可根據反應(1)和(2)的極化曲線和極化規律來判斷。金屬腐蝕體系常常是二重電極。多重電極不可能是可逆的
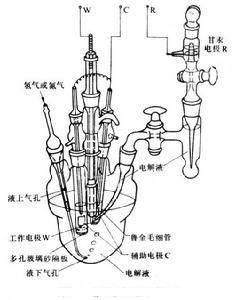 三電極測量電池系統
三電極測量電池系統實際套用時,被研究的電極稱為工作電極W,在電化學分析法中也稱指示電極,它的電勢可利用與參比電極R組成的二電極測量電池測量。當工作電極需要極化時,則要另用一輔助電極(或稱對應電極,用C表示),組成三電極測量電池系統(如右圖),以提供可調節的電流。此時為了減少電液中歐姆電位降(IR)對工作電極電勢測量的誤差,參比電極與電解液連線處應採用毛細管,使之儘量靠近工作電極,稱為魯金毛細管。
來源
原電池中的電極
電極是原電池的基本組成部分。利用自發氧化還原反應產生電流的裝置叫原電池,一個原電池必須由兩個基本部分組成:兩個電極和電解質溶液。給出電子發生氧化反應的電極,如丹尼爾電池(右圖上部所示)中的Zn極,由於其電勢較低,被稱為負極(negativeelectrode);而接受電子發生還原反應的一極,如Cu極,由於其電勢較高,而稱作正極(positiveelectrode)。根據組成電極物質的狀態,可以把電極分為三類。第一類電極是金屬電極和氣體電極,如丹尼爾電池中鋅電極和銅電極,還有標準氫電極;第二類電極是金屬-金屬難溶鹽電極及金屬-金屬難溶氧化物電極,如Ag-AgCl電極。第三類電極是氧化還原電極(任一電極皆為氧化還原電極,這裡所說的氧化還原電極是專指參加電極反應的物質均在同一個溶液中),如Fe3+,Fe2+溶液組成的電極。
電解槽中的電極
電極是電解過程中,電流進入或離開電解液的導體。電解過程就是在電極相界面上發生氧化還原反應。電極分為陰極和陽極,和電源正極相連的是陽極,陽極上發生氧化反應;和電源負極相連的是陰極,陰極上發生還原反應。
電解材料的種類很多,常用的是碳電極,此外鈦等金屬也可以做電極。在電鍍中,含有鍍層金屬的金屬往往作為陽極,待鍍製品作為陰極。