基本簡介
原電池primarybattery一種將活性物質中化學能通過氧化還原反應直接轉換成電能輸出的裝置。又稱化學電池。由於各種型號的原電池氧 原電池
原電池原電池是一類使化學能直接轉換成電能的換能裝置。原電池連續放電或間歇放電後不能以反向電流充電的方法使兩電極的活性物質回復到初始狀態,即電極活性物質只能利用一次。故亦稱一次性電池。
常見類型
兩大類型
 原電池
原電池吸氧腐蝕
金屬在酸性很弱或中性溶液里,空氣里的氧氣溶解於金屬表面水膜中而發生的電化腐蝕,叫吸氧腐蝕.
例如鋼鐵在接近中性的潮濕的空氣中腐蝕屬於吸氧腐蝕,其電極反應如下:
負極(Fe):Fe-2e=Fe2+
正極(C):2H2O+O2+4e=4OH-
鋼鐵等金屬的電化腐蝕主要是吸氧腐蝕。
析氫腐蝕
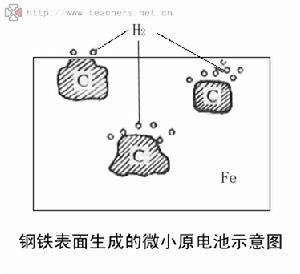
在酸性較強的溶液中發生電化腐蝕時放出氫氣,這種腐蝕叫做析氫腐蝕。在鋼鐵製品中一般都含有碳。在潮濕空氣中,鋼鐵表面會吸附水汽而形成一層薄薄的水膜。水膜中溶有二氧化碳後就變成一種電解質溶液,使水裡的H+增多。是就構成無數個以鐵為負極、碳為正極、酸性水膜為電解質溶液的微小原電池。這些原電池裡發生的氧化還原反應是:
負極(鐵):鐵被氧化Fe-2e=Fe2+
正極(碳):溶液中的H+被還原2H++2e=H2↑
這樣就形成無數的微小原電池。最後氫氣在碳的表面放出,鐵被腐蝕,所以叫析氫腐蝕。
電池分類
常用原電池有鋅-錳乾電池、鋅-汞電池、鋅-銀扣式電池及鋰電池等
1:鋅-錳乾電池:鋅-錳電池具有原材料來源豐富、工藝簡單,價格便宜、使用方便等優點,成為人們使用最多、最廣泛的電池品種。鋅-錳電池以鋅為負極,以二氧化錳為正極。按照基本結構,鋅-錳電池可製成圓筒形、扣式和扁形,扁形電池不能單個使用,可組合疊層電池(組)。按照所用電解液的差別將鋅-錳電池分為三個類型:
(1)銨型鋅-錳電池:電解質以氯化銨為主,含少量氯化鋅。
電池符號:(-)Zn│NH4Cl·ZnCl2│MnO2(+)
 原電池
原電池 總電池反應:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnO(OH)
(2)鋅型鋅-錳電池:又稱高功率鋅-錳電池,電解質為氯化鋅,具有防漏性能好,能大功率放電及能量密度較高等優點,是鋅-錳電池的第二代產品,20世紀70年代初首先由德國推出。與銨型電池相比鋅型電池長時間放電不產生水,因此電池不易漏液。
電池符號:(-)Zn│ZnCl2│MnO2(+)
總電池反應(長時間放電):
Zn+2Zn(OH)Cl+6MnO(OH)=ZnCl2·2ZnO·4H2O+2Mn3O4
(3)鹼性鋅-錳電池:這是鋅-錳電池的第三代產品,具有大功率放電性能好、能量密度高和低溫性能好等優點。
電池符號:(-)Zn│KOH│MnO2(+)
總電池反應:Zn+2H2O+2MnO2=2MnO(OH)+Zn(OH)2
鋅-錳電池額定開路電壓為1.5V,實際開路電壓1.5-1.8V,其工作電壓與放電負荷有關,負荷越重或放電電阻越小,閉路電壓越低。用於手電筒照明時,典型終止電壓為0.9V,某些收音機允許電壓降至0.75V。
原電池
2.鋰原電池:又稱鋰電池,是以金屬鋰為負極的電池總稱。鋰的電極電勢最負相對分子質量最小,導電性良好,可製成一系列貯存壽命長,工作溫度範圍寬的高能電池。根據電解液和正極物質的物理狀態,鋰電池有三種不同的類型,即:固體正極—有機電解質電池、液體正極—液體電解質電池、固體正極—固體電解質電池。Li—(CF)n的開路電壓為3.3V,比能量為480W·h·L-1,工作溫度在-55~70℃間,在20℃下可貯存10年之久!它們都是近年來研製的新產品,目前主要用於軍事、空間技術等特殊領域,在心臟起搏器等微、小功率場合也有套用。
從能量轉化角度看,原電池是將化學能轉化為電能的裝置;從化學反應角度看,原電池的原理是氧化還原反應中的還原劑失去的電子經導線傳遞給氧化劑,使氧化還原反應分別在兩個電極上進行。
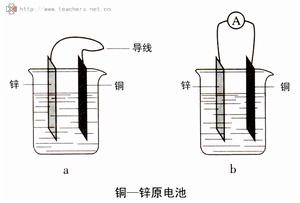
原電池的構成條件有三個:
(1)電極材料由兩種金屬活動性不同的金屬或由金屬與其他導電的材料(非金屬或某些氧化物等)組成。
(2)兩電極必須浸泡在電解質溶液中。
原電池
(3)兩電極之間有導線連線,形成閉合迴路。
只要具備以上三個條件就可構成原電池。而化學電源因為要求可以提供持續而穩定的電流,所以除了必須具備原電池的三個構成條件之外,還要求有自發進行的氧化還原反應。也就是說,化學電源必須是原電池,但原電池不一定都能做化學電池。
鋰亞電池
原電池是將化學能直接轉化為電能的一種裝置。其原理也是通過化學反應(在正負極發生不同的氧化還原反應)使閉合電路中產生電子流,從而產生電流的。原電池與二次充電電池的主要區別在於原電池只能使用一次,不能進行充電後重複使用。常用原電池有鋅-錳乾電池(鹼性電池)、鋅-汞電池、鋅-銀扣式電池及鋰原電池等。
其中,鋰原電池是指以金屬鋰為負極的原電池。按所用正極材料的不同,又可以分為:鋰/二氧化錳電池(Li/MnO2)、鋰/亞硫醯氯電池(Li/SOCl2)、鋰/二硫化鐵電池(Li/FeS2)等。
幾種常見鋰原電池性能比較
| 鋰鐵電池 | 鹼性鋅錳電池 | 鋰錳電池 | 鋰亞電池 | |
| 電壓(V) | 1.5 | 1.5 | 3.0 | 3.6 |
| 比能量(mAh/g) | 1000 | 70-90 | 200 | 400 |
| 自放電率/年 | <2% | 12%-20% | <2% | <1% |
| 保存時間 | 5-10年 | 5年 | 5-10年 | 10-15年 |
| 適用溫度(℃) | -40~60 | -22~55 | -20~70 | -55~85 |
| 放電電流 | 大 | 小 | 中 | 小 |
| 脈衝放電 | 弱 | 弱 | 弱 | 弱 |
| 價格 | 中 | 低 | 中 | 高 |
| 套用領域 | 便攜類電子產品 | 電子產品、玩具、鐘錶 | 安防、RFID、電子產品 | 智慧型儀表、軍用、汽車電子 |
通過對比發現,鋰亞電池性能優異,在所有可以實際使用的化學電源中具有最高的比容量和比能量,目前智慧型電錶是國內鋰亞電池的最大套用領域,但實際上其潛在可套用領域十分廣泛,市場遠未飽和,可重點關注鋰亞電池在胎壓監測系統、ETC收費系統、航天軍事、安防等重點領域需求的持續增長。
工作原理
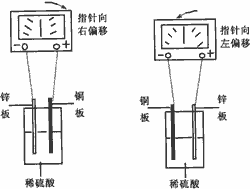 原電池
原電池原理分析:
CuCl2是強電解質且易溶於水,在水溶液中電離生成Cu2+和Cl-。
CuCl2=Cu2++2Cl-
通電前,Cu2+和Cl-在水裡自由地移動著;通電後,這些自由移動著的離子,在電場作用下,改作定向移動。溶液中帶正電的Cu2+向陰極移動,帶負電的氯離子向陽極移動。在陰極,銅離子獲得電子而還原成銅原子覆蓋在陰極上;在陽極,氯離子失去電子而被氧化成氯原子,並兩兩結合成氯分子,從陽極放出。
陰極:Cu2++2e-=Cu
陽極:Cl--2e-=Cl2↑
電解CuCl2溶液的化學反應方程式:CuCl2=Cu+Cl2↑
電解質水溶液電解反應的綜合分析
在上面敘述氯化銅電解的過程中,沒有提到溶液里的H+和OH-,其實H+和OH-雖少,但的確是存在的,只是他們沒有參加電極反應。也就是說在氯化銅溶液中,除Cu2+和Cl-外,還有H+和OH-,電解時,移向陰極的離子有Cu2+和H+,因為在這樣的實驗條件下Cu2+比H+容易得到電子,所以Cu2+在陰極上得到電子析出金屬銅。移向陽極的離子有OH-和Cl-,因為在這樣的實驗條件下,Cl-和OH-容易失去電子,所以Cl-在陽極上失去電子,生成氯氣。
發明歷史
原電池的發明歷史可追溯到18世紀末期,當時義大利生物學家伽伐尼正在進行著名的青蛙實驗,當用金屬手術刀接觸蛙腿時,發現蛙腿會抽搐。大名鼎鼎的伏打認為這是金屬與蛙腿組織液(電解質溶液)之間產生的電流刺激造成的。1800年,伏打據此設計出了被稱為伏打電堆的裝置,鋅為負極,銀為正極,用鹽水作電解質溶液。1836年,丹尼爾發明了世界上第一個實用電池,並用於早期鐵路信號燈。套用
1.直接轉換成電能輸出的裝置。又稱化學電池。由於各種型號的原電池氧化還原反應的可逆性很差,放完電後,不能重複使用,故又稱一次電池。它通常由正電極、負電極、電解質、隔離物和殼體構成,可製成各種形狀和不同尺寸,使用方便。廣泛用於工農業、國防工業和通信、照明、醫療等部門原電池
,並成為日常生活中收音機、錄音機、照相機、計算器、電子表、玩具、助聽器等常用電器的電源。原電池一般按負極活性物質(如鋅、鎘、鎂、鋰等)和正極活性物質(如錳、汞、二氧化硫、氟化碳等)分為鋅錳電池、鋅空氣電池、鋅銀電池、鋅汞電池、鎂錳電池、鋰氟化碳電池、鋰二氧化硫電池等。鋅錳電池產量最大,常按電解質分為氯化銨型和氯化鋅型,並按其隔離層分為糊式電池和低極電池。以氫氧化鉀為電解質的鋅錳電池,由於其負極(鋅)的構造與其他鋅錳電池不同而習慣上另作一類,稱為鹼性鋅錳電池,簡稱鹼錳電池,俗稱鹼性電池。
2.金屬的腐蝕與防護
①改變金屬內部結構(如把鋼中加Cr、Ni製成不鏽鋼)
②在金屬表面覆蓋保護層
a、在鋼鐵表面塗礦物性油脂、油漆或覆蓋搪瓷、塑膠等物質。
b、用電鍍、熱鍍、噴鍍的方法,在鋼鐵表面鍍上一層不易被腐蝕的金屬。
c、用化學方法使鋼鐵表面生成一層緻密而穩定的氧化膜。(表面鈍化)
③電化學保護法
a外加電流的陰極保護法(把被保護的設備與外接電源的負極相連)
b犧牲陽極的陰極保護法(被保護的設備與活潑的金屬相連線)
3.判斷金屬的活潑性
4.加快反應速率
表示方法
原電原電池
池的組成用圖示表達,未免過於麻煩。為書寫簡便,原電池的裝置常用方便而科學的符號來表示。其寫法習慣上遵循如下幾點規定:
1.一般把負極(如Zn棒與Zn2+離子溶液)寫在電池符號表示式的左邊,正極(如Cu棒與Cu2+離子溶液)寫在電池符號表示式的右邊。
2.以化學式表示電池中各物質的組成,溶液要標上活度或濃度(mol/L),若為氣體物質應註明其分壓(Pa),還應標明當時的溫度。如不寫出,則溫度為298.15K,氣體分壓為101.325kPa,溶液濃度為1mol/L。
3.以符號“∣”表示不同物相之間的接界,用“‖”表示鹽橋。同一相中的不同物質之間用“,”隔開。
4.非金屬或氣體不導電,因此非金屬元素在不同氧化值時構成的氧化還原電對作半電池時,需外加惰性導體(如
原電池
鉑或石墨等)做電極導體。其中,惰性導體不參與電極反應,只起導電(輸送或接送電子)的作用,故稱為“惰性”電極。
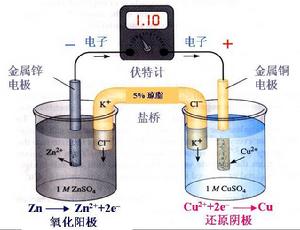
按上述規定,Cu-Zn原電池可用如下電池符號表示:
(-)Zn(s)∣Zn2+(C)‖Cu2+(C)∣Cu(s)(+)
理論上,任何氧化還原反應都可以設計成原電池,例如反應:
Cl2+2H-═2Cl-+H2此反應可分解為兩個半電池反應:
負極:2H-═H2+2e-(氧化反應)
正極:Cl2+2e-═2Cl-(還原反應)
該原電池的符號為:
(-)Pt∣I2(s)∣I-(C)‖Cl-(C)∣C2(PCL2)∣Pt(+)
常見電池
常用原電池有鋅-錳乾電池、鋅-汞電池、鋅-銀扣式電池及鋰電池等。鋅-錳乾電池
鋅-錳電池具有原材料來源豐富、工藝簡單,價格便宜、使用方便等優點,成為人們使用最多、最廣泛的電池品種。鋅-錳電池以鋅為負極,以二氧化錳為正極。按照基本結構,鋅-錳電池可製成圓筒形、扣式和扁形,扁形電池不能單個使用,可組合疊層電池(組)。按照所用電解液的差別將鋅-錳電池分為三個類型:
(1)銨型鋅-錳電池:電解質以氯化銨為主,含少量氯化鋅。
電池符號:(-)Zn│NH4Cl·ZnCl2│MnO2(+)
總電池反應:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+Mn2O3+H2O
(2)鋅型鋅-錳電池:又稱高功率鋅-錳電池,電解質為氯化鋅,具有防漏性能好,能大功率放電及能量密度較高等優點,是鋅-錳電池的第二代產品,20世紀70年代初首先由德國推出。與銨
原電池
型電池相比鋅型電池長時間放電不產生水,因此電池不易漏液。
電池符號:(-)Zn│ZnCl2│MnO2(+)
總電池反應(長時間放電):
Zn+2Zn(OH)Cl+6MnO(OH)=ZnCl2·2ZnO·4H2O+2Mn3O4
(3)鹼性鋅-錳電池:這是鋅-錳電池的第三代產品,具有大功率放電性能好、能量密度高和低溫性能好等優點。
電池符號:(-)Zn│KOH│MnO2(+)
總電池反應:Zn+2H2O+2MnO2=2Mn(OH)2+Zn(OH)2
鋅-錳電池額定開路電壓為1.5V,實際開路電壓1.5-1.8V,其工作電壓與放電負荷有關,負荷越重或放電電阻越小,閉路電壓越低。用於手電筒照明時,典型終止電壓為0.9V,某些收音機允許電壓降至0.75V。
鋰原電池
又稱鋰電池,是以金屬鋰為負極的電池總稱。鋰的電極電勢最負相對分子質量最小,導電性良好,可製成一系列貯存壽命長,工作溫度範圍寬的高能電池。根據電解液和正極物質的物理狀態,鋰電池有三種不同的類型,即:固體正極—有機電解質電池、液體正極—液體電解質電池、固體正極—固體電解質電池。Li—(CF)n的開路電壓為3.3V,比能量為480W·h·L-1,工作溫度在-55~70℃間,在20℃下可貯存10年之久!它們都是研製的新產品,主要用於軍事、空間技術等特殊領域,在心臟起搏器等微、小功率場合也有套用。
鋰電池與鋰離子電池不同。前者是一次電池,後者可反覆充電。
鋰電池
電壓約3V,電池容量及輸出的電池極高,可以存放十年仍有相當電力,但價錢較貴。
其他的一次性電池包括有鋅電池、鋅空電池、鋅汞電池、水銀電池、氫氧電池和鎂錳電池。
原電池與二次充電電池的主要區別在於原電池只能使用一次,不能進行充電後重複使用。常用原電池有鋅-錳乾電池(鹼性電池)、鋅-汞電池、鋅-銀扣式電池及鋰原電池等。
幾種常見鋰原電池性能比較通過對比發現,鋰亞電池性能優異,在所有可以實際使用的化學電源中具有較高的比容量和比能量,目前智慧型電錶是國內鋰亞電池的最大套用領域,但實際上其潛在可套用領域十分廣泛,市場遠未飽和,可重點關注鋰亞電池在胎壓監測系統、ETC收費系統、航天軍事、安防等重點領域需求的持續增長。
燃料電池
燃料電池是一種不經燃燒,將燃料的化學能經過電化學反應直接轉變為電能的裝置,它和其他電池中的氧化還原反應一樣,都是自發的化學反應,不會發出火焰,其化學能可以直接轉化為電能的一種電池。所有的燃料電池的工作原理都是一樣的,其電極反應的書寫同樣是有規律可循的。一般燃料電池發生的電化學反應的最終產物與燃燒產物相同,可根據燃燒反應寫出總的電池反應,但不註明反應的條件。負極發生氧化反應,正極發生還原反應,不過要注意一般電解質溶液要參與電極反應。
現以氫氧燃料電池為例進行說明:
氫氧燃料電池一般是以惰性金屬鉑(Pt)做電極材料,負極通入H2,正極通入O2,電解質溶液通常選用KOH。在負極上氫氣失去電子變成H+進入溶液,H+又與溶液中的OH-繼續反應生成H2O,因此在負極發生的反應為H2–2e-=2H+,H++2OH-=H2O,所以:
負極的電極反應式為:2H2–4e-+4OH-=4H2O;
正極是O2得到電子,即:O2+4e-=2O2-,O2-在鹼性條件下不能單獨存在,只能結合H2O生成OH-即:O2-+H2O=2OH-,因此:
正極反應式為:O2+2H2O+4e-=4OH-。
總反應為:2H2+O2=2H2O。
注意:若在酸性條件下,
負極反應式為:2H2-4e-=4H+
正極反應式為:O2+4H++4e-=2H2O(O2+4e-=2O2-,2O2-+4H+=2H2O)
總反應為:2H2+O2=2H2O。
腐蝕類型
析氫腐蝕定義
金屬在酸性較強的溶液里放出氫氣的電化學的腐蝕叫做析氫腐蝕。
成因
在鋼鐵製品中一般都含有石墨(C)或碳化鐵(Fe3C)。在潮濕空氣中,鋼鐵表面會吸附水汽而形成一層薄薄的水膜。水膜中溶有二氧化碳或二氧化硫後就變成一種電解質溶液,使水裡的H+增多:
CO2+H2O←→H2CO3←→H++HCO3-
SO2+H2O←→H2SO3←→H++HSO3-
於是就產生了無數個以鐵為負極、碳或碳化鐵為正極、酸性水膜為電解質溶液的微小原電池。
電極反應
負極(鐵):鐵被氧化Fe-2e-=Fe2+
正極(碳或碳化鐵):溶液中的H+被還原2H++2e-=H2↑
結果
最後氫氣在碳的表面放出,鐵被腐蝕,所以叫析氫腐蝕。
吸氧腐蝕
定義
金屬在酸性很弱或中性溶液里,空氣里的氧氣溶解於金屬表面水膜中而發生的電化學腐蝕,叫吸氧腐蝕。
電極反應
負極(鐵):2Fe-4e-=2Fe2+
正極(碳或碳化鐵):2H2O+O2+4e-=4OH-
吸氧腐蝕的必要條件
發生吸氧腐蝕的必要條件是金屬的電位比氧還原反應的電位低。
氧的陰極還原過程及其過電位
吸氧腐蝕的陰極去極化劑是溶液中溶解的氧。隨著腐蝕的進行,氧不斷消耗,只有來自空氣中的氧進行補充。因此,氧從空氣中進入溶液並遷移到陰極表面發生還原反應,這一過程包括一系列步驟。
1.氧穿過空氣/溶液界面進入溶液;
2.在溶液對流作用下,氧遷移到陰極表面附近;
3.在擴散層範圍內,氧在濃度梯度作用下擴散到陰極表面;
4.在陰極表面氧分子發生還原反應,也叫氧的離子化反應。
吸氧腐蝕的控制過程及特點
金屬發生氧去極化腐蝕時,多數情況下陽極過程發生金屬活性溶解,腐蝕過程處於陰極控制之下。氧去極化腐蝕速度主要取決於溶解氧向電極表面的傳遞速度和氧在電極表面上的放電速度。因此,可粗略地將氧去極化腐蝕分為三種情況。
1.如果腐蝕金屬在溶液中的電位較高,腐蝕過程中氧的傳遞速度又很大,則金屬腐蝕速度主要由氧在電極上的放電速度決定。
2.如果腐蝕金屬在溶液中的電位非常低,不論氧的傳輸速度大小,陰極過程將由氧去極化和氫離子去極化兩個反應共同組成。
3.如果腐蝕金屬在溶液中的電位較低,處於活性溶解狀態,而氧的傳輸速度又有限,則金屬腐蝕速度由氧的極限擴散電流密度決定。
擴散控制的腐蝕過程中,由於腐蝕速度只決定於氧的擴散速度,因而在一定範圍內,腐蝕電流將不受陽極極化曲線的斜率和起始電位的影響。
擴散控制的腐蝕過程中,金屬中不同的陰極性雜質或微陰極數量的增加,對腐蝕速度的增加只起很小的作用。方程式
負極:活潑金屬失電子,看陽離子能否在電解液中大量存在。如果金屬陽離子不能與電解液中的離子共存,則進行進一步的反應。例:甲烷燃料電池中,電解液為KOH,負極甲烷失8個
電子生成CO2和H2O,但CO2不能與OH-共存,要進一步反應生成碳酸根。
正極:①當負極材料能與電解液直接反應時,溶液中的陽離子得電子。例:鋅銅原電池中,電解液為HCl,正極H+得電子生成H2。②當負極材料不能與電解液反應時,溶解在電解液中的O2得電子。如果電解液呈酸性,O2+4e-+4H+==2H2O;如果電解液呈中性或鹼性,O2+4e-+2H2O==4OH-。
特殊情況:Mg-Al-NaOH,極。負極:Al-3e-+4OH-==AlO2-+2H2O;正極:2H2O+2e-==H2↑+2OH-
Cu-Al-HNO3,Cu作負極。
注意:Fe作負極時,氧化產物是Fe2+而不可能是Fe3+;肼(N2H4)和NH3的電池反應產物是H2O和N2
無論是總反應,還是電極反應,都必須滿足電子守恆、電荷守恆、質量守恆。
pH變化規律
電極周圍:消耗OH-(H+),則電極周圍溶液的pH減小(增大);反應生成OH-(H+),則電極周圍溶液的pH增大(減小)。切記,電極周圍只要消耗OH-,PH就減小,不會受“原電池中OH-(陰離子)向負極移動”的影響。
溶液:若總反應的結果是消耗OH-(H+),則溶液的pH減小(增大);若總反應的結果是生成OH-(H+),則溶液的pH增大(減小);若總反應消耗和生成OH-(H+)的物質的量相等,則溶液的pH由溶液的酸鹼性決定,溶液呈鹼性則pH增大,溶液呈酸性則pH減小,溶液呈中性則pH不變。
舉例
1.Cu─H2SO4─Zn原電池
正極:2H++2e-→H2↑
負極:Zn-2e-→Zn2+
總反應式:Zn+2H+==Zn2++H2↑
2.Cu─FeCl3─C原電池
正極:2Fe3++2e-→2Fe2+
負極:Cu-2e-→Cu2+
總反應式:2Fe3++Cu=2Fe2++Cu2+
3.鋼鐵在潮濕的空氣中發生吸氧腐蝕
正極:O2+2H2O+4e-→4OH-
負極:2Fe-4e-→2Fe2+
總反應式:2Fe+O2+2H2O=2Fe(OH)2
4.氫氧燃料電池(鹼性介質)
正極:O2+2H2O+4e-→4OH-
負極:2H2-4e-+4OH-→4H2O
總反應式:2H2+O2==2H2O
5.氫氧燃料電池(酸性介質)
正極:O2+4H++4e-→2H2O
負極:2H2-4e-→4H+
總反應式:2H2+O2=2H2O
6.氫氧燃料電池(中性介質)
正極:O2+2H2O+4e-→4OH-
負極:2H2-4e-→4H+
總反應式:2H2+O2=2H2O
7.鉛蓄電池(放電)
正極(PbO2):
PbO2+2e-+SO42-+4H+→PbSO4+2H2O
負極(Pb):Pb-2e-+(SO4)2-→PbSO4
總反應式:
Pb+PbO2+4H++2(SO4)2=2PbSO4+2H2O
8.Al─NaOH─Mg原電池
正極:6H2O+6e-→3H2↑+6OH-
負極:2Al-6e-+8OH-→2AlO2-+4H2O
總反應式:2Al+2OH-+2H2O=2AlO2-+3H2↑
9.CH4燃料電池(鹼性介質)
正極:2O2+4H2O+8e-→8OH-
負極:CH4-8e-+10OH-→(CO3)2-+7H2O
總反應式:CH4+2O2+2OH=(CO3)2-+3H2O
10.熔融碳酸鹽燃料電池
(Li2CO3和Na2CO3熔融鹽作電解液,CO作燃料):
正極:O2+2CO2+4e-→2(CO3)2-(持續補充CO2氣體)
負極:2CO+2(CO3)2--4e-→4CO2
總反應式:2CO+O2=2CO2
11.銀鋅紐扣電池(鹼性介質)
正極(Ag2O):Ag2O+H2O+2e-→2Ag+2OH-
負極(Zn):Zn+2OH-2e-→ZnO+H2O
總反應式:Zn+Ag2O=ZnO+2Ag
12.鹼性鋅錳電池(KOH介質)
正極(MnO2):2MnO2+2H2O+2e-→2MnOOH+2OH-
負極(Zn):Zn+2OH-2e-→Zn(OH)2
總反應式:Zn+2MnO2+2H2O→2MnOOH+Zn(OH)2
蓄電池 蓄電池在放電過程中屬於原電池反應。這類電極反應都有電解質溶液參與,如果能分析清楚電解質溶液是否參與電極反應,那么負極的電極反應式和正極的電極反應式的書寫就可迎刃而解了。
現以鉛酸蓄電池為例來分析電極反應式的書寫方法。
鉛酸蓄電池的總反應為:Pb+PbO2+H2SO4=2PbSO4+2H2O
根據原電池的工作原理分析,負極失去電子發生氧化反應,可知:
Pb–2e-=Pb2+①,生成的Pb2+進入電解質溶液中,Pb2+與溶液中的SO42-不能共存,要繼續反應生成PbSO4,即:Pb2++SO42-=PbSO4②,因此在原電池的負極反應式為①+②即:Pb–2e-+SO42-=PbSO4;正極是得電子發生還原反應的一極,則有:PbO2+2e-=Pb2++2O2-①,Pb2+和O2-進入溶液中,由於電解質溶液是H2SO4溶液,O2-在酸性環境中,不能單獨存在,可供O2-結合的微粒由H+和H2O,O2-在酸性環境中優先結合H+生成H2O,這樣在正極發生的反應有:4H++2O2-=2H2O②;Pb2++SO42-=PbSO4③根據以上分析可知正極反應式為①+②+③即:PbO2+2e-+SO42+4H+=PbSO4+2H2O。(注意:在電極反應式中應遵循電荷守恆和質量守恆;在負極反應式與正極反應式相加求總反應時要注意得失電子數要相等。)
再如:Ag—Zn高能電池(鈕扣電池)由Ag2O、Zn及KOH溶液組成。總反應為:Zn+Ag2O+H2O=Zn(OH)2+2Ag
根據原電池原理可知:Zn做負,Ag2O做正極,電解質溶液為KOH溶液。負極極失去電子發生氧化反應,則負極反應為:Zn–2e-=Zn2+,Zn2+進入溶液後又與溶液中的OH-反應Zn2++2OH-=Zn(OH)2。
所以負極反應為:Zn–2e-+2OH-=Zn(OH)2;
正極為Ag2O得到電子發生還原反應,即Ag2O+2e-=2Ag+O2-
O2-在中性或鹼性環境中也不能單獨存在,只能結合H2O生成OH-,故在中性或鹼性條件下O2-+H2O=2OH-,所以正極反應式為:Ag2O+2e-+H2O=2Ag+2OH-。
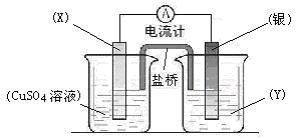
鹽橋
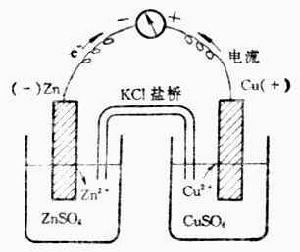
如Cu-Zn原電池中以KCl溶液做電解質KCl在這個裝置中稱為鹽橋。
鹽橋的作用僅僅是導電【相當於導線的作用】,將兩個燒杯形成閉合迴路,否則就相當於斷開,而鹽橋的導電是利用了其中的陰陽離子的定向移動。
鋅銅電池,電解質溶液鋅端硫酸鋅,銅端硫酸銅,即兩端不一樣,所以產生電勢差,於是,電子從負極Zn失去,沿著導線移向正極Cu,即外面的導線中,電子即負電荷從Zn到Cu,中間有鹽橋連線,即鹽橋中的負電荷即陰離子應該從CuSO4的一端沿著鹽橋移向ZnSO4的一端,或者說,鹽橋中的正電荷即陽離子就從ZnSO4的一端沿著鹽橋移向CuSO4的一端,總之,要保證兩端燒杯中的正負電荷要守恆。
【溶液中是靠硫酸銅和硫酸鋅自己的離子導電,他們自已各擔其職】
還有以含有離子的瓊脂塊作鹽橋的,套用很廣泛。
種類
碳鋅電池俗稱碳性電池,電壓約1.5V,售價最平,但電池容量較低,能輸出的電池也較低,幾乎被鹼錳電池所取代,唯獨是不會在長期存放後漏出有害腐蝕液體,所以仍被使用於低用電量同時需長期使用的裝置,例如鍾、紅外線搖控等。為了增加正極的導電性,一般會以粉末狀碳和二氧化錳圍繞碳棒作正極,所以又稱為鋅錳電池電池。電解質一般採用氯化銨,當中也有為了容量或輸出電流而改用氯化鋅為電解質(通常標示為“HeavyDuty”)。
鹼錳電池
電壓約1.5V,電池容量及輸出的電壓較鋅錳電池高,但不及鎳氫電池,長期存放後漏出有害腐蝕液體。
要求
為安全使用和處理原電池,2009年4月29日,中國國家標準化管理委員會(SAC)發布了國家標準《民用原電池安全通用要求》。本標準規定了民用原電池的分類、安全性能要求、標誌、電池選購、使用、更換和處理指南、電器具的電池艙安全設計指南。本標準適用於民用的各類水溶液電解質原電池(鹼性和非鹼性鋅-二氧化錳電池、鋅-氧化銀電池、鋅-羥基氧化鎳電池、鹼性和中性鋅-空氣電池)以及各類鋰原電池(鋰-氟化碳電池、鋰-二氧化錳電池、鋰-亞硫醯氯電池、鋰-二硫化鐵電池、鋰-二氧化硫和鋰-氧化銅電池等)的生產、檢測和驗收。
可逆原電池即放電後能充電反覆使用要求兩極的電極反應均為可逆反應。
作用
硫化礦原電池效應研究現狀
 原電池
原電池指出建立天然硫化物礦物原電池地球化學,從源頭上實現消除或減弱硫化礦原電池效應導致的重金屬離子和酸性礦山排水環境污染,將成為今後原電池效應在地學的重要研究方向。
原電池在污水處理中的作用
1、可將某些大分子物質降解為小分子中間產物,脫色效果較好(此外,反應產生了亞鐵離子和鐵離子);
2、可去除活性比鐵弱的重金屬,置換反應,因此,微電解法也用於銅氨絡合廢水等,銅氨絡合廢水經微電解後的混凝過程無污泥上浮現象,我認為,氨氮也得到去除;
3、微電解池入水ph要求3.0左右,混凝工藝要求回調至8.5左右,藥費過高;微電解池一般底部進水,須增加提升泵(如水解池與調節池合建地埋,則可忽略);水解池出水攜帶少量SS,長此以往易導致微電解池堵塞。因此,是否“微電解+水解+好氧”是否更合理?原水為酸性則更好,如為鹼性,不如直接混凝處理。
我國發布《民用原電池安全通用要求》
為安全使用和處理原電池,2009年4月29日,中國國家標準化管理委員會(SAC)發布了國家標準《民用原電池安全通用要求》。本標準規定了民用原電池的分類、安全性能要求、標誌、電池選購、使用、更換和處理指南、電器具的電池艙安全設計指南。
本標準適用於民用的各類水溶液電解質原電池(鹼性和非鹼性鋅-二氧化錳電池、鋅-氧化銀電池、鋅-羥基氧化鎳電池、鹼性和中性鋅-空氣電池)以及各類鋰原電池(鋰-氟化碳電池、鋰-二氧化錳電池、鋰-亞硫醯氯電池、鋰-二硫化鐵電池、鋰-二氧化硫和鋰-氧化銅電池等)的生產、檢測和驗收。
化學與物理術語(一)
| 通過對化學和物理的了解,來明白生活中的細節,從而使我們更好的明白一些事物。 |
![原電池[教學設計] 原電池[教學設計]](/img/4/4fa/nBnauM3XzMTN0MzNwgDN1AzN3QTMxEzNwQTMzQTNwAzMwIzL4QzLwAzLt92YucmbvRWdo5Cd0FmLwE2LvoDc0RHa.jpg)
