來源
 磷酸
磷酸磷酸的原料主要是磷礦和無機酸(硫酸、鹽酸或硝酸,主要為硫酸)。天然磷礦分磷灰石和磷塊岩兩大類,其主要成分都是氟磷酸鈣〔Ca10F2(PO4)6〕。磷礦的品位和有害雜質的種類及含量,對濕法磷酸生產的技術經濟影響很大,開採的磷礦一般需經過富集處理,提高其品位和排除雜質,方能滿足濕法磷酸生產的要求。
性質
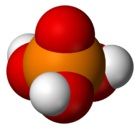
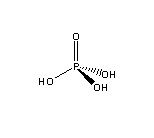 分子結構
分子結構(一)物理性質
純淨的磷酸是無色晶體,分子式為H3PO4,高沸點酸,易溶於水。市售磷酸試劑是粘稠的、不揮發的濃溶液,磷酸含量83-98%。
(二)化學性質
磷酸是三元中強酸,分三步電離,不易揮發,不易分解,幾乎沒有氧化性。具有酸的通性。
與鹼反應
NaOH+H3PO4=NaH2PO4+H2O;
2NaOH+H3PO4=Na2HPO4+2H2O;
3NaOH+H3PO4=Na3PO4+3H2O。
與某些鹽反應
NaBr+H3PO4(濃)=NaH2PO4+HBr↑
NaI+H3PO4(濃)=NaH2PO4+HI↑
(三)磷酸根離子具有很強的配合能力,能與許多金屬離子生成可溶性的配合物。如Fe與PO4可以生成無色的可溶性的配合物[Fe(PO4)2]和[Fe(HPO4)2],利用這一性質,分析化學上常用PO4掩蔽Fe離子。
(四)磷酸受強熱時脫水,依次生成焦磷酸、三磷酸和多聚的偏磷酸。三磷酸是鏈狀結構,多聚的偏磷酸是環狀結構。
(五)檢測:若在待測液中滴加AgNO3溶液,有黃色沉澱生成,再滴入稀HNO3,黃色沉澱溶解,則可證明原溶液中含有PO4。若待測液呈酸性,
則應先在待測液中滴氨水至中性,再滴加AgNO3溶液和稀HNO3。用途
無機工業用於生產酸式磷酸錳、焦磷酸鉀及各種磷酸鹽類。醫藥工業用於製造甘油、磷酸鈉、神經系統藥劑)、牙料粘合劑)及青黴素的Ph調節劑等。
 磷酸
磷酸磷酸鹽
磷酸鹽有三類:正鹽(含PO4)、磷酸一氫鹽(含HPO4)、磷酸二氫鹽(含H2PO)。
1、溶解性規律:正鹽和一氫鹽:除鉀、鈉、銨等少數鹽外,其餘都難溶於水,但能溶於強酸。二氫鹽:都易溶於水。
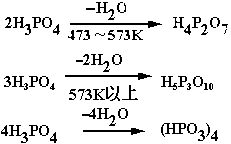 化學反應
化學反應2、相互轉化:
a、往澄清石灰水中逐滴滴加H3PO4,邊滴邊振盪。現象:開始有白色沉澱生成,而後逐漸溶解。
反應方程式:
3Ca(OH)2+2H3PO4=Ca3(PO4)2↓+6H2O
Ca3(PO4)2+H3PO4=3CaHPO4
CaHPO4+H3PO4=Ca(H2PO4)2
b、往磷酸溶液中逐滴滴加澄清石灰水,邊滴加振盪。現象:開始無現象,當澄清石灰水滴到一定量時,有白色沉澱生成。
反應方程式:
Ca(OH)2+2H3PO4=Ca(H2PO4)2+2H2O
Ca(H2PO4)2+Ca(OH)2=2CaHPO4↓
2CaHPO4+Ca(OH)2=Ca3(PO4)2+2H2O
3、離子共存的問題
(1)H2PO4 、HPO4、PO4與H不能共存
(2)H2PO4、HPO4與OH不能共存
(3)H2PO4與PO4不能共存,H2PO4+PO4 =2HPO4(4)H2PO4與HPO4、HPO4與PO4可共存
生產工藝
主要是用硫酸分解磷礦,然後將生成的磷酸與硫酸鈣分離。其主要反應式為:
Ca10F2(PO4)6 +10H2SO4+mH2O─→10CaSO4·nH2O+2HF+6H3PO4 +(m-10n)H2O
磷酸
為避免反應生成的硫酸鈣在磷礦顆粒表面形成膜層,阻礙反應繼續進行,工藝上反應過程是分成兩步進行。
第一步是磷礦溶解在磷酸(由後續工序返回的一部分)中生成磷酸一鈣;
第二步是硫酸與磷酸一鈣反應生成磷酸和硫酸鈣。
濕法生產
濕法磷酸生產工藝稱為硫酸鈣再結晶工藝,其過程中包含著有硫酸鈣結晶水合物的轉變。
發展這類工藝的目的不外乎是為了獲得含P2O5濃度較高的磷酸;獲得較高的收率(以P2O5計);獲得含雜質少的石膏。已經實現了工業化的有三種:
①半水物-二水物一段過濾工藝。控制反應物料液相濃度為30%~32%P2O5、反應溫度80~100℃,使硫酸鈣先生成半水物結晶,然後溫度下降為65℃左右,將結晶轉化為二水物後再過濾。
②半水物-二水物兩段過濾工藝。用酸分解磷礦時使石膏先生成半水物結晶,控制反應物料液相濃度為40%~50%P2O5、溫度90~110℃,進行半水石膏分離,獲得成品磷酸。半水石膏再轉入另一個反應器水化成二水物石膏,控制反應溫度為約65℃、磷酸濃度為10%~15%P2O5,進行二水物石膏分離。
③二水物-半水物兩段過濾工藝。磷礦用酸分解時,使石膏先生成二水物結晶,控制溫度約為65℃,用離心機分離二水石膏,獲得濃度為35%~38%P2O5的成品,二水石膏轉入再結晶器轉化成半水石膏,控制磷酸濃度為20%~25%P2O5,硫酸濃度為約20%H2SO4,反應溫度為80~100℃,分離半水石膏,濾洗液返回二水物結晶槽。
濕法磷酸的生產,仍以二水物流程為主,占世界生產能力的90%以上。原因是技術較為可靠、工藝操作條件的範圍寬、設備材料的腐蝕比較容易解決和投資低等。
熱法生產
熱法磷酸是黃磷在空氣中燃燒生成五氧化二磷,再經水化製成。
1838年,首次製成工業用的黃磷,1855~1890年間在歐洲建立了黃磷的生產廠。20世紀40~50年代,美國和德國發展了黃磷和熱法磷酸的生產技術。60年代,美國曾計畫大量發展黃磷和熱法磷酸生產以用於肥料工業,旨在利用便宜的能源和運輸黃磷比較經濟的優點,後由於能源漲價,計畫未能實現。熱法磷酸比濕法磷酸濃度高,且產品純,但耗電量大,價格昂貴。在水電有富餘的地區,熱法磷酸具有發展前途。現在除了蘇聯有少量用於肥料生產外,熱法磷酸主要用於工業方面。1981年世界產量為3.145Mt(P2O5)。含矽高的磷礦,適宜於元素磷生產。含鐵、鎂和鋁雜質高的磷礦用於黃磷生產時,將使電耗增加、磷收率降低。
有兩種生產流程:一種是把燃燒和水化安排在同一塔內進行,液態磷從塔頂向下噴霧,空氣由塔頂吸入,磷在塔中燃燒,冷的磷酸噴入塔內,使五氧化二磷進行水化反應,一部分冷的磷酸從塔頂形成膜層沿壁向下流動,以保護塔壁。從塔底部抽出熱法磷酸送去冷卻後返回塔頂。另一種是把燃燒和水化分開在兩個塔內進行,在塔的外壁大量噴水以移除反應熱。
多磷酸生產
生產方法有熱法和濕法兩種。熱法多磷酸生產只需在熱法磷酸的生產過程中強化冷卻系統,使五氧化二磷在少量水的情況下水化即可。濕法多磷酸生產是將濃度為52%~54%P2O5的磷酸進一步脫水。有三種脫水工藝:浸沒燃燒脫水;膜式蒸發脫水;強制循環真空蒸發脫水。
安全性
危害性
對健康的危害:
蒸氣或霧對眼、鼻、喉有刺激性。
口服液體可引起噁心、嘔吐、腹痛、血便或體克。皮膚或眼接觸可致灼傷。
毒性:屬低毒類。
急性毒性:LD501530mg/kg(大鼠經口);2740mg/kg(兔經皮)
刺激性:兔經皮595mg/24小時,嚴重刺激;兔眼119mg嚴重刺激。慢性影響:鼻黏膜萎縮、鼻中隔穿孔。長期反覆皮膚接觸,可引起皮膚刺激。
泄漏應急處理
疏散泄漏污染區人員至安全區,禁止無關人員進入污染區,建議應急處理人員戴好防毒面具,穿化學防護服。不要直接接觸泄漏物,用沙土、乾燥石灰或蘇打灰混合,然後收集轉移到安全場所或以少量加入大量水中,調節至中性,再放入廢水系統。如大量泄漏,收集回收或無害處理後廢棄。
廢棄物處置方法:建議把廢料緩慢地加到鹼液-石灰水中,攪拌後,用大量水沖入下水道。
防護措施
呼吸系統防護:空氣中濃度超標時,必須佩帶防毒面具或供氣式頭盔。緊急事態搶救或逃生時,建議佩帶自給式呼吸器。
眼睛防護:戴化學安全防護眼鏡。
防護服:穿工作服(防腐材料製作)。
手防護:戴橡皮手套。
其它:工作後,淋浴更衣。單獨存放被毒物污染的衣服,洗後再用。保持良好的衛生習慣。
急救措施
皮膚接觸:脫去污染的衣著,立即用流動清水徹底沖洗。若有灼傷,按酸灼傷處理。
眼睛接觸:立即提起眼瞼,用流動清水或生理鹽水沖洗至少15分鐘。就醫。
吸入:脫離現場至空氣新鮮處。必要時進行人工呼吸。就醫。
食入:誤服者立即漱口,給飲牛奶或蛋清。就醫。
滅火方法:泡沫、二氧化碳、砂土、乾粉。
其他
 磷酸鹽調料
磷酸鹽調料根據美國食品化學藥碘(FCC)磷酸鹽在食品工業中的功能可分為15類:
1、酸味劑:磷酸
2、抗結塊劑:磷酸鈣
3、抗氧化劑:次磷酸鈣
4、緩衝劑:磷酸氫二銨、磷酸二氫銨、磷酸氫鈣、磷酸鈣、焦磷酸鈣、磷酸二氫鉀、磷酸氫二鉀、酸式焦磷酸鈉、磷酸二氫鈉、磷酸氫二鈉、磷酸鈉、焦磷酸鈉
5、麵團改良劑:磷酸氫二銨、磷酸二氫銨、磷酸二氫鈣、磷酸氫鈣
6、乳化劑:磷酸鉀、聚偏磷酸鉀、焦磷酸鉀、磷酸鋁鈉(鹼性)、偏磷酸鈉(不溶性)、磷酸二氫鈉、磷酸氫二鈉、聚磷酸鈉(玻璃質)、焦磷酸鈉
7、硬化劑:磷酸二氫鈣
8、保濕劑:聚偏磷酸鉀
9、發酵劑:磷酸氫二銨、磷酸二氫銨、酸式焦磷酸鈉、磷酸鋁鈉(酸性)
10、營養劑:磷酸二氫鈣、磷酸氫鈣、磷酸鈣、焦磷酸鈣、磷酸鐵、焦磷酸鐵、磷酸氫鎂、磷酸鎂、次磷酸錳、焦磷酸鐵鈉、磷酸二氫鈉、磷酸氫二鈉、磷酸鈉、焦磷酸鈉
11、防腐劑:次磷酸鈉。
12、螯合劑:磷酸二氫鈣、磷酸、磷酸二氫鉀、磷酸氫二鉀、酸式焦磷酸鈉、偏磷酸鈉(不溶性),聚磷酸鈉(玻璃狀)。
13、改良澱粉添加劑:三偏焦磷酸、磷酸二氫鉀。
14、組織改良劑:焦磷酸鉀、三聚磷酸鉀、偏磷酸鈉(不溶性)、磷酸氫二鈉(玻璃質)、三聚磷酸鈉。
15、發酵食品:磷酸二氫銨、磷酸氫二銨、磷酸二氫鈣、磷酸二氫鈣、磷酸二氫鉀、磷酸氫二鉀。
由上可看出:磷酸鹽在食品加工中的功能主要有兩點,一是品質改良劑,二是營養強化劑。
磷酸的危害
蒸氣或霧對眼、鼻、喉有刺激性。口服液體可引起噁心、嘔吐、腹痛、血便或休克。皮膚或眼接觸可致灼傷。慢性影響:鼻黏膜萎縮、鼻中隔穿孔。長期反覆皮膚接觸,可引起皮膚刺激。
磷酸中毒後如何急救
1、皮膚接觸:立即脫去污染的衣著,用大量流動清水沖洗至少15分鐘。儘快就醫。
2、眼睛接觸:立即提起眼瞼,用大量流動清水或生理鹽水徹底沖洗至少15分鐘。儘快就醫。
3、吸入:迅速脫離現場至空氣新鮮處,保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。儘快就醫。
4、食入:誤服者立即漱口,給飲牛奶或蛋清。儘快就醫。
如何安全防範
密閉操作,注意通風。儘可能機械化、自動化。提供安全淋浴和洗眼設備。可能接觸其蒸氣時,必須佩戴自吸過濾式防毒面具(半面罩),可能接觸其粉塵時,建議佩戴自吸過濾式防塵口罩。戴化學安全防護眼鏡,穿膠布耐酸鹼服,戴橡膠耐酸鹼手套。工作現場禁止吸菸、進食和飲水,飯前要洗手。工作畢,淋浴更衣。單獨存放被毒物污染的衣服,洗後備用。保持良好的衛生習慣。