物化性質
 氫氧化鋁
氫氧化鋁氫氧化鋁與酸反應:Al(OH)3+3HCl==AlCl3+3H2O(可用來中和胃酸)
Al(OH)3+3H+→Al3++3H2O
氫氧化鋁與鹼反應:Al(OH)3+NaOH→Na[Al(OH)4]==NaAlO2+2H2O
氫氧化鋁在鹼性環境中異構反應:Al(OH)3→H3AlO3(鋁酸)
Al(OH)3+OH-→AlO2-+2H2O
氫氧化鋁受熱分解:2Al(OH)3==加熱==Al2O3+3H2O
氫氧化鋁水中兩種電離:
1、Al(OH)3→Al3++3OH-(鹼式電離)
2、Al(OH)3+H2O→[Al(OH)4]-+H+(酸式電離)
其中的[Al(OH)4]-中學上習慣寫成AlO2-,但是實際上這是錯誤的。
一般所謂的氫氧化鋁實際上是指三氧化二鋁的水合物。如向鋁鹽溶液中加入氨水或鹼而得到的白色膠狀沉澱,其含水量不定,組成也不均勻,統稱為水合氧化鋁。只有在鋁酸鹽溶液中(含有Al(OH)4-離子)的溶液中通CO2才可得到真正的氫氧化鋁。
結晶的氫氧化鋁與水合氧化鋁不同,難溶於酸,加熱到373K也不脫水,在573K加熱2h才能轉變為偏氫氧化鋁(AlO(OH))。
氫氧化鋁屬兩性氫氧化物。由於其存在兩種電離形式,既是弱酸,可以有酸式化學式H3AlO3,又是弱鹼,可以有鹼式化學式Al(OH)3。氫氧化鋁具有兩性,既能與酸反應又能與鹼反應。
氫氧化鋁的酸性在於它是路易斯酸可以加合OH-,從而體現鹼性
Al(OH)3由於兩種電離的存在,可以產生兩種鹽:鋁元素兩種鹽:
⒈鋁鹽:Al3+AlCl3,KAl(SO4)2·12H2O(明礬)。它們的水溶液因Al3+的水解而顯酸性分別滴加AgNO3和稀硝酸,產生白色沉澱的為Cl-;產生淺黃色沉澱的為Br-;產生黃色沉澱的為I-
2.偏鋁酸鹽,AlO2-NaAlO2,KAlO2.它們的水溶液呈鹼性:AlO2-+2H2O→Al(OH)3+OH-當兩類鹽混合時,即發生雙水解反應,生成Al(OH)3Al3++3AlO2-+6H2O==4Al(OH)3↓
氫氧化鋁主要有325目、800目、1250目、5000目四個規格。白色粉末狀固體。幾乎不溶於水,能凝聚水中的懸浮物,吸附色素。
技術指標
指標名稱優級品一級品合格品外觀白色粉末狀晶體,不應有夾雜物
Al(OH)3含量/%≥99.7899.7399.58
SiO2/%≤0.010.060.10
Fe2O3/%≤0.030.030.05
Na2O3/%≤0.200.250.40
附著水/%≤0.050.100.25
國外牌號有H系列ATH(美國)、B-103(105)系列ATH(日本)。
製備方法
1、拜耳法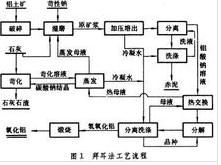 拜耳法工藝流程
拜耳法工藝流程由於三水鋁石、一水軟鋁石和一水硬鋁石的結晶構造不同,它們在苛性鈉溶液中的溶解性能有很大差異,所以要提供不同的溶出條件,主要是不同的溶出溫度。三水鋁石型鋁土礦可在125~140℃下溶出,一水硬鋁石型鋁土礦則要在240~260℃並添加石灰(3~7%)的條件下溶出。
現代拜耳法的主要進展在於:①設備的大型化和連續操作;②生產過程的自動化;③節省能量,例如高壓強化溶出和流態化焙燒;④生產砂狀氧化鋁以滿足鋁電解和煙氣乾式淨化的需要。拜耳法的工藝流程見圖。
氫氧化鋁製備1
拜耳法的優點主要是流程簡單、投資省和能耗較低,最低者每噸氧化鋁的能耗僅3×106千卡左右,鹼耗一般為100公斤左右(以Na2CO3計)。
拜耳法生產的經濟效果決定於鋁土礦的質量,主要是礦石中的SiO2含量,通常以礦石的鋁矽比,即礦石中的Al2O3與SiO2含量的重量比來表示。因為在拜耳法的溶出過程中,SiO2轉變成方鈉石型的水合鋁矽酸鈉(Na2O?Al2O3?1.7SiO2?nH2O),隨同赤泥排出。礦石中每公斤SiO2大約要造成1公斤Al2O3和0.8公斤NaOH的損失。鋁土礦的鋁矽比越低,拜耳法的經濟效果越差。直到70年代後期,拜耳法所處理的鋁土礦的鋁矽比均大於7~8。由於高品位三水鋁石型鋁土礦資源逐漸減少,如何利用其他類型的低品位鋁礦資源和節能新工藝等問題,已是研究、開發的重要方向。2、鹼石灰燒結法
 氫氧化鋁
氫氧化鋁鹼石灰燒結法的主要化學反應如下:
燒結:
Al2O3+Na2CO3─→Na2O?Al2O3+CO2
Fe2O3+Na2CO3─→Na2O?Fe2O3+CO2
SiO2+2CaCO3─→2CaO?SiO2+2CO2
TiO2+CaCO3─→CaO?TiO2+CO2
熟料溶出:
Na2O?Al2O3+4H2O─→2NaAl(OH)4(溶解)
Na2O?Fe2O3+2H2O─→Fe2O3?H2O↓+2NaOH(水解)
脫矽:
1.7Na2SiO3+2NaAl(OH)4─→Na2O?Al2O3?1.7SiO2?nH2O↓+3.4NaOH
3Ca(OH)2+2NaAl(OH)4+xNa2SiO3─→3CaO?Al2O3?xSiO2?(6-2x)H2O↓+2(1+x)NaOH
分解:
2NaOH+CO2─→Na2CO3+H2O
NaAl(OH)4─→Al(OH)3↓+NaOH
中國鹼石灰燒結法生產氧化鋁的主要技術成就是:在熟料燒成中採用低鹼比配方,在熟料溶出工藝中採用二段磨料和低分子比溶液,以抑制溶出時的副反應損失,使熟料中Na2O和Al2O3的溶出率分別達到94~96%和92~94%。Al2O3的總回收率約90%,每噸氧化鋁的Na2CO3的消耗量約95公斤。鹼石灰燒結法可以處理拜耳法不能經濟地利用的低品位礦石,其鋁矽比可低至3.5,且原料的綜合利用較好,有其特色。
氫氧化鋁製備2
 拜耳-燒結聯合法
拜耳-燒結聯合法可充分發揮兩法優點,取長補短,利用鋁矽比較低的鋁土礦,求得更好的經濟效果。聯合法有多種形式,均以拜耳法為主,而輔以燒結法。按聯合法的目的和流程連線方式不同,又可分為串聯法、並聯法和混聯法三種工藝流程。
①串聯法是用燒結法回收拜耳法赤泥中的Na2O和Al2O3,用於處理拜耳法不能經濟利用的三水鋁石型鋁土礦。擴大了原料資源,減少鹼耗,用較廉價的純鹼代替燒鹼,而且Al2O3的回收率也較高。
②並聯法是拜耳法與燒結法平行作業,分別處理鋁土礦,但燒結法只占總生產能力的10~15%,用燒結法流程轉化產生的NaOH補充拜耳法流程中NaOH的消耗。
③混聯法是前兩種聯合法的綜合。此法中的燒結法除了處理拜耳法赤泥外,還處理一部分低品位礦石。
中國根據本國的鋁礦資源特點,發展出多種氧化鋁生產方法。50年代初就已用鹼石灰燒結法處理鋁矽比只有3.5的純一水硬鋁石型鋁土礦,開創了具有特色的氧化鋁生產體系。用中國的燒結法,可使Al2O3的總回收率達到90%;每噸氧化鋁的鹼耗(Na2CO3)約90公斤;氧化鋁的SiO2含量下降到0.02~0.04%;而且在50年代已經從流程中綜合回收金屬鎵和利用赤泥生產水泥。60年代初建成了拜耳燒結混聯法氧化鋁廠,使Al2O3總回收率達到91%,每噸氧化鋁的鹼耗下降到60公斤,為高效率地處理較高品位的一水硬鋁石型鋁土礦開創了一條新路。中國在用單純拜耳法處理高品位一水硬鋁石型鋁土礦方面也積累了不少經驗。
根據物理特性的不同,電解用氧化鋁可分為三類:砂狀、粉狀和中間狀。
安全風險
安全術語
S26Incaseofcontactwitheyes,rinseimmediatelywithplentyofwaterandseekmedicaladvice.不慎與眼睛接觸後,請立即用大量清水沖洗並徵求醫生意見。
S36Wearsuitableprotectiveclothing.
穿戴適當的防護服
風險術語
R36Irritatingtoeyes.刺激眼睛。
技術指標
 氫氧化鋁
氫氧化鋁不小於灼減(灼熱減量)
不大於雜質含量不大於
SiO2Fe2O3NA2O
AH-164.5350.020.020.4
AH-264.0350.040.030.5
AH-363.5350.080.050.6
註:
1、Al2O3含量為100%減去灼減和表所列雜質的實質含量之差。
2、表中化學成份按在110±5℃溫度下烘乾2h的乾基計算。
3、表中雜質成份按GB8170數字修約規則處理。
包裝貯運
包裝:內塑外編覆膜袋,每袋淨重25kg或40kg。運輸:該品為非危險品,運輸過程中防止受潮、雨淋和包裝破損。
貯存:貯存在乾燥通風的庫房內。
實驗室製法
 氫氧化鋁
氫氧化鋁2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Al2(SO4)3+6NaAlO2+12H2O=8Al(OH)3↓+3Na2(SO4) 或Al2(SO4)3+6NH3.H2O=2Al(OH)3↓+3(NH4)2SO4
離子方程式:2Al+6H+=2Al3++3H2↑
2Al+2OH-+2H2O=2NaAlO2+3H2↑
Al+3AlO2+6H2O=4Al(OH)3↓
或Al+3NH3·H2O=Al(OH)3↓+3NH4+
①Al(OH)3是兩性氫氧化物,在常溫下它既能與強酸,又能與強鹼反應:
Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+3H+=Al3++3H2O
Al(OH)3+NaOH=NaAlO2+2H2OAl(OH)3+OH-=AlO2-+2H2O
②Al(OH)3受熱易分解成Al2O3:2Al(OH)3==Al2O3+3H2O(規律:不溶性鹼受熱均會分解)
③Al(OH)3的製備:
a、可溶性鋁鹽和氨水反應來製備Al(OH)3
AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4(Al3++3NH3·H2O=Al(OH)3↓+3NH4+)
因為強鹼(如NaOH)易與Al(OH)3反應,所以實驗室不用強鹼製備Al(OH)3,而用氨水
b、偏鋁酸鈉與過量二氧化碳反應
NaAlO2+CO2+2H2O=NaHCO3+Al(OH)3↓
過量的碳酸不與氫氧化鋁反應,保證Al全部生成氫氧化鋁
抗酸藥及治療消化性潰瘍病藥
| 泮托拉唑 | 普勞諾托 | 曲昔派特 | 舒可捷 | 斯達舒膠囊 |泰妥拉唑 | 胃丙胺片 | 胃舒平 | 西曲酸酯 | 胸腺蛋白口服液 | 鹽酸雷尼替丁 | 碳酸氫鈉 | 氧化鎂 | 氫氧化鋁 | 鋁碳酸鎂 | 西咪替丁 | 雷尼替丁 | 枸櫞酸鉍雷尼替丁 | 法莫替丁 | 尼扎替丁 | 奧美拉唑 | 蘭索拉唑 | 泮托拉唑 | 雷貝拉唑 | 三甲硫苯嗪 | 格隆溴銨 | 哌侖西平 | 丙谷胺 | 枸櫞酸鉍鉀 | 膠體果膠鉍 | 米索前列醇 | 硫糖鋁 | 甘珀酸鈉 | 胃膜素 | 麥滋林-s | 替普瑞酮 | 吉法酯 | 甘草鋅 | 胃仙U | 胃得樂 | 胃必妥片 | 丁溴東莨菪鹼 | 其它類奧曲肽 | 蓋胃平 |

