發現簡史
 1.3611千克蘇聯產高純金屬銫
1.3611千克蘇聯產高純金屬銫銫最終被基爾霍夫教授和本生於1860年在德國的海德堡被發現。他們檢測了來自Durkheim的礦物質水,並且在光譜中觀察到了他們不能認出的線,這意味著一個新的元素的出現。他們從這個來源生產出了約7克氯化銫,但沒能生產出這種新金屬自身的樣本。第一個成功制出金屬銫的這個榮譽歸屬於波恩大學的考爾· 希歐多爾·賽特伯格(Carl Theodor Setterberg)教授,他由電解熔融的氰化銫(CsCN)獲取了它。
命名是由其發現者基爾霍夫教授和本生以拉丁文“coesius”(意為天藍色)命名了銫。
礦藏分布
 國產金屬銫
國產金屬銫銫在地殼中含量為3×10%,銫榴石是含銫礦物,也是提取銫的主要原料。已發現34種銫的同位素,除銫–133是唯一存在於自然界的穩定同位素;其餘皆是鈾裂變產生的放射性同位素。
Durkheim的礦物質水中含有豐富的銫化合物,所以可以從Durkheim的礦物質水提取。
銫元素一般分布在含礦物質較多的水中。
理化性質
物理性質
 金屬銫
金屬銫銫位於第六周期的鹼金屬(IA)族,是帶金黃色的鹼金屬,非常柔軟(它的莫氏硬度是所有元素中最低的),具有延展性。金屬銫是沒有放射性的,但是金屬銫屬於危險化學品,屬遇濕易燃和自燃物品。使用時應小心。
天然存在的銫133是一種穩定同位素,而其他銫同位素則屬於放射性。
| 密度 | 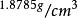 銫 銫 |
| 熔點 | 28.40℃(83.1℉),接近室溫 |
| 沸點 | 678.4℃ |
化學性質
同位素Cs-137:
銫的生物行為與鉀相似,食用了含銫–137的生物可溶化合物24小時後,銫–137可被人體充分吸收並結合在細胞內,造成內照射。
銫-137可作為γ輻射源,用於輻射育種、輻照儲存食品、醫療器械的殺菌、癌症的治療以及工業設備的γ探傷等。由於銫源的半衰期較長及其易造成擴散的弱點,故銫-137源已漸被鈷-60源所取代。
2011年3月29日,在安徽省、廣東省、廣西壯族自治區和寧夏回族自治區的監測點氣溶膠取樣中還檢測到了極微量的人工放射性核素銫-137和銫-134,其濃度均在10-5貝克/立方米量級及以下。環境中銫-137進入人體後易被吸收,均勻分布於全身;由於銫-137能釋放γ射線,很容易在體外測出。進入體內的放射性銫主要滯留在全身軟組織中,尤其是肌肉中,在骨和脂肪中濃度較低;較大量放射性銫攝入體內後可引起急、慢性損傷。
其放射性及簡要特性:
| 核素 | 化學 符號 | 原子 序數 | 主要放射性 同位素 | 半衰期 | 來源 | 毒性 |
| 銫 | Cs | 55 | 137Cs | 30.0年 | 人工 | 中毒 |
 銫137
銫137銫的化學性質極為活潑,銫在空氣中生成一層灰藍色的氧化銫,不到一分鐘就可以自燃起來,發出深紫紅色的火焰,生成很複雜的銫的氧化物。
銫在鹼金屬中是最活潑的,能和氧發生劇烈反應,生成多種銫氧化物。在潮濕空氣中,氧化的熱量足以使銫熔化並燃燒。銫不與氮反應,但在高溫下能與氫化合,生成相當穩定的氫化物。銫能與水發生劇烈的反應,如果把銫放進盛有水的水槽中,馬上就會發生爆炸。甚至和溫度低到-116℃的冰均可發生猛烈反應產生氫氣、氫氧化銫,生成的氫氧化銫是無放射性的氫氧化鹼中鹼性最強的。與鹵素也可生成穩定的鹵化物,這是由於它的離子半徑大所帶來的特點。銫和有機物也會發生同其他鹼金屬相類似的反應,但它比較活潑。
銫鹽跟鉀鹽、鈉鹽一樣溶於所有鹽溶液中。但是高氯酸鹽不溶。
碘化銫與三碘化鉍反應能生成難溶的亮紅色復鹽,此反套用來定性和定量測定銫;銫的火焰呈比鉀深的紫紅色,可用來檢驗銫。
化合物:銫在空氣中氧化不僅僅得到氧化銫、過氧化銫,還有超氧化銫、臭氧化銫等複雜的非整比化合物產生。
Cs的鹽通常是無色的,除非陰離子有顏色(如高錳酸銫是紫色的)。 許多簡單的鹽具有潮解性,但比更輕的其他鹼金屬弱。銫的乙酸鹽、碳酸鹽、鹵化物、氧化物、硝酸鹽和硫酸鹽可溶於水。復鹽通常溶解度較小,硫酸鋁銫溶解度較小的性質常用來從礦石中提純銫。與銻(例如CsSbCl)、鉍、鎘、銅、鐵和鉛形成的復鹽通常溶解度很小。
氫氧化銫(CsOH)是一種具有強烈吸水性的強鹼。它能迅速腐蝕半導體材料(例如矽)的表面。 過去化學家曾認為CsOH是“最強的鹼”,但是許多化合物的鹼性(質子鹼性)遠比CsOH強,例如正丁基鋰,氫化銫和氨基鈉。
製備方法
銫可以用電解法和熱還原法製備。但是由於對電極有強腐蝕性,工業上一般不用電解法。所以工業上是由氯化銫高溫用金屬鈣還原製取金屬銫。
 銫
銫套用領域
裂變產物
長壽命的銫–137是鈾-235的裂變產物。半衰期30.17年,可輻射β射線和γ射線,用作β和γ輻射源,用於工農業和醫療。隨著核燃料放射性廢物儲放的時間,其輻射的γ射線比例增加;是儲存的主要對象。
離子火箭
為了探索宇宙,必須有一種嶄新的、飛行速度極快的交通工具。一般的火箭、飛船都達不到這樣的速度,最多只能衝出地月系;只有每小時能飛行十幾萬公里的“離子火箭”才能滿足要求。
銫原子的最外層電子極不穩定,很容易被激發放射出來,變成為帶正電的銫離子,所以是宇宙航行離子火箭發動機理想的“燃料”。銫離子火箭的工作原理是這樣的:發動機開動後,產生大量的銫蒸氣,銫蒸氣經過離化器的“加工”,變成了帶正電的銫離子,接著在磁場的作用下加速到每秒一百五十公里,從噴管噴射出去,同時給離子火箭以強大的推動力,把火箭高度推向前進。
計算表明,用這種銫離子作宇宙火箭的推進劑,單位重量產生的推力要比使用的液體或固體燃料高出上百倍。這種銫離子火箭可以在宇宙太空遨遊一二年甚至更久!
原子鐘
銫原子的最外層的電子繞著原子核旋轉的速度,總是極其精確地在幾十億分之一秒的時間內轉完一圈,穩定性比地球繞軸自轉高得多。利用銫原子的這個特點,人們製成了一種新型的鐘——銫原子鐘,規定一秒就是銫原子“振動”9192631770次(即相當於銫原子的兩個超精細電子遷躍9192631770次)所需要的時間。這就是“秒”的最新定義。
利用銫原子鐘,人們可以十分精確地測量出十億分之一秒的時間,精確度和穩定性遠遠地超過世界上以前有過的任何一種表,也超過了許多年來一直以地球自轉作基準的天文時間。有了像銫原子鐘這樣一類的鐘表,人類就有可能從事更為精細的科學研究和生產實踐,比如對核子彈和氫彈的爆炸、火箭和飛彈的發射以及宇宙航行等等,實行高度精確的控制,當然也可以用於遠程飛行和航海。用銫作成的原子鐘,可以精確的測出十億分之一秒的一剎那,它連續走上三十萬年,誤差也不超過1s,精確度相當高.,另外,銫在醫學上、飛彈上、宇宙飛船上及各種高科技行業中都有廣泛套用。
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||
元素性質
| 為了方便閱讀者查閱元素周期表中各元素符號的性質及特點,比較系統的歸納和總結各元素的套用價值及注意事項,從而為需要相關知識的人們形成知識的鏈條,本次主要是對有些元素的內容進行補充及完善。 |