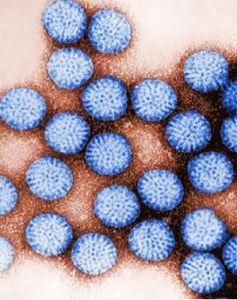
簡介
 輪狀病毒片
輪狀病毒片每年有超過500,000名五歲以下的兒童因為輪狀病毒的感染而死亡,而且每年有幾乎兩百萬以上的兒童因此患重病。在美國,輪狀病毒每年造成270萬個兒童嚴重腸胃炎的案例,每年幾乎有60,000名兒童住院治療,並且每年平均有37個死亡案例。公共衛生與輪狀病毒作戰的方式著重於提供感染的兒童口服葡萄糖電解質液治療(oral rehydration therapy)並且以疫苗接種來防止這種疾病的發生。
球形,70nm,核酸,分階段的雙鏈RNA,結構穩定,耐熱,耐酸鹼,表面有血凝素,抑制V與ecll的接觸,可用胰酶破壞血凝素,培養較困難,MA—104恆河猴傳代cell培養,引起小兒秋冬腹瀉(HRV)屬A組,核酸電泳:分階段4-2-2-3,成人輪狀病毒屬B組 電泳模式4-2-24,C組 電泳模式 4-3-2-2 D組 電泳模式5-2-2-2,A、B組形態上無法區分,可通過電泳區別,秋冬交接時期謹防輪狀病毒。據介紹,輪狀病毒有明顯的季節性,它特別喜歡在20攝氏度左右氣溫下活躍。在廣州,秋冬交接時期尤其要注意。兒童多集中在每年10月至12月期間感染輪狀病毒。
發現歷史
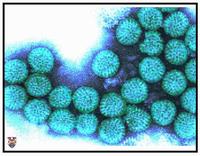 輪狀病毒形態
輪狀病毒形態1974年,湯瑪斯·亨利·費留特(Thomas Henry Flewett)在通過電子顯微鏡觀察過這類病毒之後,建議將其命名為“輪狀病毒”(rotavirus),因為輪狀病毒的顆粒看起來很像輪子,而拉丁文中“rota”的意思即為“輪狀”;這個名稱四年後經由國際病毒分類委員會(International Committee on Taxonomy of Viruses)正式認可。1976年,相關類似的病毒也在許多其他種動物的研究上被描述到。這些被報告描述的病毒,通通都會導致急性腸胃炎,並且被認定為影響全世界人類與動物的集體病原體。輪狀病毒的血清型於1980年首次發表,而在隔年,來自人體的輪狀病毒藉由添加胰蛋白酶(一種發現於哺乳動物十二指腸的酶,目前已知是輪狀病毒複製所必須的物質)首次在從自然環境中猴子腎臟取得的細胞培養中成功栽培。成功培養輪狀病毒的能力加速了研究的腳步,且在1980年代中期,首批候選的疫苗已經開始進行評估。
1998年,首種輪狀病毒疫苗(Rotavirus vaccine)獲得在美國使用的執照。在美國、芬蘭與委內瑞拉的臨床試驗發現該疫苗可以對於成功預防輪狀病毒A種所產生的嚴重腹瀉比率高達80%至100%,而研究者也沒有發現顯著的嚴重藥物不良反應。然而,在該疫苗被發現會增加腸套疊(即腸梗阻(bowel obstruction)的一種)的風險之後,疫苗製造商在1999年將疫苗從市場上全部撤回,研究顯示每12,000注射過疫苗的嬰兒有一個會有腸套疊的症狀。這次經驗也引發了關於輪狀病毒疫苗的相關風險與益處的激烈爭論。2006年,兩種對抗輪狀病毒A種的新疫苗被證明對兒童是安全而且是有效預防的。
預防
選擇接種疫苗可以降低感染對初冬感染輪狀病毒的嬰幼兒患者,臨床沒有特效藥物快速治療。有專家特別提醒,“家長在小兒患病期間切忌亂用抗生素治療,以防引起不良後果。”
不少患兒選擇接種輪狀病毒的疫苗,不過輪狀病毒有很多種類,檢驗設備只能驗出有該病毒,無法查出病毒屬於哪一類型,因此打疫苗後仍有機會感染,不過接種後就算受到感染可有八成幾率避免出現重症。
病徵
輪狀病毒腸胃炎是一種從溫和到嚴重的疾病,有一些表征像是嘔吐,水狀腹瀉,以及低程度的發熱。當兒童受到這類病毒感染時,在症狀發生前大約會有兩天的潛伏期(incubation period)。症狀通常是從嘔吐開始,接著是四到八天的大量腹瀉。輪狀病毒感染較容易造成脫水的細菌性病原體還要更常引起脫水的現象,也因此,脫水成為輪狀病毒感染的最常見的死因。
在人一生中,感染輪狀病毒A種會有這樣的經過:第一次感染通常會產生症狀,但是下一次的感染通常會是典型的無症狀,因為免疫系統提供了部分的保護機制。所以,感染症狀發生的比例於兩歲以下的兒童最高,之後漸漸降低直到45歲為止。雖然新生兒感染的機會很常見,但是通常都是溫和的症狀或是無症狀疾病;最嚴重的症狀都會發生在比較大一點的出生六個月到兩歲的小孩,以及發生在有免疫缺陷(immunodeficiency)的小孩身上。因為從童年獲得的免疫力,大部分的成人對於輪狀病毒並不易受到影響;成人發生的腸胃炎通常是因為其他並因而非輪狀病毒,但是成人的無症狀感染依然在社群中帶有感染症的傳染性。有症狀的再感染通常因為感染了不同血清型的輪狀病毒A種。
傳染途徑
輪狀病毒是由糞口路徑(fecal-oral route)所傳染的,藉由與接觸弄髒的手、弄髒的表面以及弄髒的物體來傳染,而且有可能經由呼吸路徑傳染[1]。受感染病患的糞便每克可以包含超過1000億億個有傳染性的病毒顆粒;而其中只要10顆到100顆就可以藉由傳播而感染另一個人。
輪狀病毒在自然環境中是穩定的,也可以在河口的樣本中發現,其樣本大概每美制加侖可以發現1至5顆有傳染性的輪狀病毒顆粒。消滅細菌與寄生蟲的衛生設備似乎對於輪狀病毒的控制是無效的,因為在高衛生水平與低衛生水平的國家中,輪狀病毒感染的發病率是相似的。
發病機制
腹瀉是肇因於輪狀病毒的多重活動。因為稱之為腸黏膜細胞(enterocyte)的腸細胞遭到該病毒的破壞而導致吸收不良(malabsorption)。產生腸毒素(enterotoxin)的病毒蛋白質NSP4製造了倚賴鈣離子的氯化分泌物,破壞了鈉-葡萄糖協同運輸蛋白1(sodium-glucose transport 1,SGLT1)載體居中調節的水份再吸收,這個顯然降低了刷狀緣(brush border)薄膜雙糖酵素(disaccharidase)的活動,而且可能激化腸神經系統中依賴鈣離子的分泌(secretion)的反射作用。健康的腸黏膜細胞會分泌乳糖酶進入小腸;所以因乳糖酶缺乏而造成的乳糖不耐症也是輪狀病毒感染經常出現的症狀,這個症狀可以持續數周。乳糖不耐症的再次發生通常與牛奶再次引入兒童的日常飲食有關,因為細菌發酵了在肚子內的雙糖乳糖。
診斷與檢測
輪狀病毒感染的診斷正常都是診斷出腸胃炎並且有嚴重腹瀉的狀況之後。大部分的因為腸胃炎進入醫院的兒童病患都被檢測出輪狀病毒A種。對於輪狀病毒A種傳染病的專門診斷方式是對病患的糞便利用酵素免疫分析法去作病毒的識別。市場上已經有幾種核准的監測設備,這些監測設備對於輪狀病毒A種的所有血清型都可以敏感,個別的檢測出來。其他的檢驗方法,如電子顯微鏡法或是凝膠電泳法,則是使用在研究實驗室之中。逆轉錄聚合酶鏈鎖反應(RT-PCR)可以檢測並識別所有種與所有血清型的人類輪狀病毒。
流行病學
在全世界各地流行的輪狀病毒A種據統計是人類輪狀病毒腸胃炎案例中超過90%以上的病媒,每年輪狀病毒在開發中國家造成上億的腹瀉案例,有接近200萬的病患住院治療,而且據估計有611,000的死亡案例。單獨就美國而言,平均每年就發生超過270萬件輪狀病毒腸胃炎的案例,約60,000的病童必須住院治療,而且有37名病童因為這個病毒感染症而死亡。而輪狀病毒是引起腹瀉的主要角色並沒有受到廣泛的被公共衛生社群所承認,特別是開發中國家。幾乎每個兒童在五歲以前都曾感染過輪狀病毒。它是嬰兒與幼兒嚴重腹瀉的主要單一原因,其中大約20%的嬰幼兒腹瀉案例是歸因於此,而統計大約50%的案例需要住院治療。男孩住院治療的案例為女孩住院治療的兩倍。
在溫帶地區,輪狀病毒感染症主要發生於冬季,但是在熱帶地區則是一年全年都會發生;其中的不同之處有部分可以用溫帶地區溫度與濕度季節性的變化來解釋。對於可歸因食物污染的數據尚未清楚。
輪狀病毒A種腹瀉經常在醫院的嬰兒、參加託兒所的幼兒,以及在照養中心的老人之間爆發。1981年在美國科羅拉多州發生一次因為市區飲用水遭到污染而爆發大規模輪狀病毒感染。而在2005年期間,紀錄上最大的腹瀉大規模傳染病疫情發生在尼加拉瓜。這次不尋常大且嚴重的疫情爆發是伴隨著輪狀病毒A種基因突變,也許這幫助了病毒逃離了民眾體內普遍免疫力的保護。另外一次類似的流行性大爆發則是發生在1977年的巴西。
輪狀病毒B種,也稱為成人腹瀉輪狀病毒(adult diarrhoea rotavirus,ADRV),造成影響上千名中國各年齡層人民的嚴重腹瀉大規模傳染病。這些已經發生的傳染病都是因為污水污染了飲用水的結果。輪狀病毒B種感染也發生在1998年的印度;這次成因的病毒株被命名為CAL,不像ADRV,CAL病毒株是地方性的。目前為止,因為輪狀病毒B種引起的流行病已經被限制在中國大陸,但是研究指出美國普遍缺乏對於該種病毒的免疫力。
輪狀病毒C種出現在許多國家中的小孩腹瀉的極少數偶發案例中,但是在日本與英格蘭曾經爆發過大規模流行。
預防方法
於2006年,兩種對抗輪狀病毒A種感染的疫苗已經證明對兒童是安全而且有效的:分別是由葛蘭素史克製造的“羅特律”(Rotarix®)與由默克大藥廠製造的“輪達停”(RotaTeq®)。兩種疫苗皆是用口服接種,並且都包含了無作用力的活病毒。輪狀病毒疫苗目前在澳大利亞、歐洲、加拿大、巴西、埃及、印度、以色列、中國台灣、南非、巴拿馬、阿根廷與美國等地都可以取得。
輪狀病毒疫苗計畫(Rotavirus Vaccine Program)是一個適宜衛生科技組織(Program for Appropriate Technology in Health,簡寫為 PATH)、世界衛生組織與美國疾病控制與預防中心的合作計畫,該計畫由全球疫苗與免疫聯盟(GAVI Alliance)資助。該計畫的目的是藉由製造可以讓開發中國家使用的輪狀病毒疫苗,來降低兒童因為痢疾而產生的疾病與兒童死亡率。
動物的感染
輪狀病毒也會感染年幼的動物並造成腹瀉。各項研究顯示,輪狀病毒會感染哺乳動物(如:猿猴、牛、豬、羊、田鼠、貓與狗、家鼠、馬與兔子等)以及鳥類(雞與火雞等)等。這些感染動物的輪狀病毒是有與感染人類的輪狀病毒產生基因交換的潛在可能性。目前已經證明感染動物的輪狀病毒也可以感染人類,感染途徑包括病毒的直接傳染以及提供感染人類的病毒株一段或是數段的核糖核酸片段來進行基因重整(reassortment)。輪狀病毒是家畜的病原體之一,並且治療的費用、家畜的高罹病率與高死亡率都會造成農人的經濟損失。
病毒學
輪狀病毒的種類
輪狀病毒總共有七種,分別以英文字母編號為A、B、C、D、E、F與G等。人類主要是受到輪狀病毒A種、B種與C種的感染,而其中最常見的是輪狀病毒A種的感染。而這七種輪狀病毒都會在其他動物身上造成疾病。
在輪狀病毒A種之中有不同的病毒株,稱之為血清變異株(serovar)。與流行性感冒病毒類似,輪狀病毒使用了雙重的分類系統,這樣分類法是依據這個病毒體表面的兩個結構性蛋白質來作分類的。糖蛋白VP7定義了G型而對於蛋白酶敏感的蛋白質VP4則定義了P型(這些蛋白質的細節請見下文)。P型會以一個數字來標示出P血清型,並用方括弧內部的一個數字來標示所對應的P基因型。G血清型的表示方法很類似,但是G基因型的數字會與G血清型的數字相同。舉個例來說,“輪狀病毒Wa病毒株”(rotavirus strain Wa)就會被標示成“P1A[8]G1”。因為這兩個決定G型跟P型的基因可以被分開傳送而產生後代,所以兩基因不同的組合就會產生各種不同的病毒株。
結構
輪狀病毒的基因組包括了11條獨特的核糖核酸雙螺鏇分子,這11條中總共有18,555個核苷鹼基對。每一條螺鏇或是分段即是一個基因,並且依照分子尺寸由大到小依次編號為1到11。每一個基因都可以編碼成一種蛋白質,而其中第9基因與第11基因比較特別,它們都可以編碼成兩種蛋白質。核糖核酸外圍則是包圍了三層二十面體的蛋白質殼體。病毒顆粒大約直徑76.5 nm,並且並沒有病毒包膜(Viral envelope)。蛋白質
有六個病毒蛋白質(viral protein,VP)架構了整個病毒顆粒(病毒體)。這些“結構性”的蛋白質分別被稱為VP1、VP2、VP3、VP4、VP6與VP7。除了這些結構性蛋白質之外,還有六個非結構性蛋白質(nonstructural protein,NSP),這六個蛋白質僅僅在輪狀病毒感染的細胞中製造,而沒有構成病毒體的結構。這六個非結構性蛋白質分別稱為NSP1、NSP2、NSP3、NSP4、NSP5與NSP6。由輪狀病毒基因組所編碼的12個蛋白質中,至少6個會與核糖核酸結合。這些蛋白質在輪狀病毒複製時所扮演的角色目前還沒有完全被了解;它們的功用被認為有可能是與病毒體核心糖核酸的合成與包裝相關,或是與將信使核糖核酸輸送至基因體複製現場相關,或是與信使核糖核酸轉譯與基因表現調節相關。
結構性蛋白
VP1蛋白質位於病毒體核心,是一種核糖核酸聚合酶。在被感染的細胞中,這種酶會產生病毒蛋白質合成所需的信使核糖核酸轉錄複本,以及產生輪狀病毒基因體核糖核酸片段拷貝來提供新產生的病毒體使用。VP2蛋白質形成病毒體的核心層,並且結合核糖核酸基因體。
VP3蛋白質是病毒體核心的一部分,而且是一種稱為鳥苷酸轉移酶(guanylyl transferase)的酶。這種酶是一種加帽酶(Capping enzyme),也就是製作信使核糖核酸轉錄後修飾時候所用的5'端帽的酶。這個5'端帽保護病毒的信使核糖核酸免受核酸酶(以核酸為底物的水解酶)水解,使之能夠保持穩定。
VP4蛋白質位於病毒體的表面,突出來而成為一個刺突(spike)。它連線細胞表面的受體分子,並且驅使病毒進入那個細胞。在病毒有傳染性之前,VP4蛋白質會被一種可以在內臟發現的蛋白酶改變成VP5*蛋白質與VP8*蛋白質。VP4蛋白質決定了該病毒的毒性(Virulence),而它也決定了該病毒的P型。
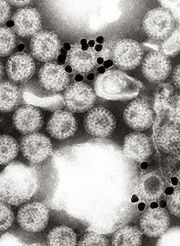 黏在輪狀病毒上的金奈米粒電子顯微鏡影像。圖中的黑色小圓盤是塗上一層單株抗體的金奈米粒,這個單株抗體是專門針對VP6蛋白質製造的。
黏在輪狀病毒上的金奈米粒電子顯微鏡影像。圖中的黑色小圓盤是塗上一層單株抗體的金奈米粒,這個單株抗體是專門針對VP6蛋白質製造的。VP6蛋白質形成殼體的體積。它是抗原性強的蛋白質,並且可以被用來分辨輪狀病毒的種類。這個蛋白質被實驗室用來進行輪狀病毒A種感染症的各種測試上。
VP7蛋白質是一種建立病毒體外層表面的糖蛋白。扣除掉它在病毒結構上的功用之外,它也決定該病毒珠的G型。VP7蛋白質跟VP4蛋白質一樣,都被免疫力(immunity)當作是防止感染的途徑。
病毒的非結構性蛋白
NSP1蛋白質是第5號基因的產物,是一種非結構性蛋白質,而且也是核糖核酸結合蛋白質(RNA-binding protein)。NSP2蛋白質是一種核糖核酸結合蛋白質,此種蛋白質會堆積於細胞質內含物(即病毒質,viroplasm)之中,並且是一種基因體複製時所需的蛋白質。
NSP3蛋白質受到感染細胞中的病毒信使核糖核酸影響,它負責停止細胞蛋白質合成的工作。
NSP4蛋白質是一種病毒性腸毒素(enterotoxin),會引起腹瀉的症狀。此蛋白質是首種發現的病毒性腸毒素。
NSP5蛋白質是由輪狀病毒A種基因體第11號基因編碼的產物。而在受病毒感染的細胞中,NSP5蛋白質堆積在病毒質中。
NSP6蛋白質是一個結合核酸的蛋白質,是由第11號基因於開放閱讀框架階段的編碼產物。
複製
輪狀病毒感染小腸絨毛(villi)的腸黏膜細胞,改變上皮組織的結構與功能。輪狀病毒的三重蛋白質外層使它們可以抵抗胃中的胃酸以及消化系統中的消化酶(digestive enzyme)。
病毒藉由受體媒介的內吞作用進入細胞,並且形成一個稱作核內體(endosome)的囊泡。輪狀病毒第三層的蛋白質(即VP7與VP4刺突)會分解核內體的外膜,而創造一個鈣濃度不同的外膜。這個改變導致了VP7蛋白質三聚體破裂為一個單一蛋白質的子單元,留下圍繞在病毒雙鏈核糖核酸外面的VP2與VP6蛋白質,形成雙層構造的病毒顆粒(DLP)。
七條雙鏈核糖核酸鏈依舊維持兩層蛋白質層,並提供病毒核糖核酸依賴性的核糖核酸聚合酶(RNA replicase或RNA-dependent RNA polymerase,RdRp)創造雙鏈病毒基因體的信使核糖核酸轉錄複本的保護。藉由把病毒核糖核酸保持於病毒核心,病毒核糖核酸躲避了先天宿主的免疫反應。這個免疫反應稱為RNA干擾,會因為雙鏈核糖核酸鏈的表現而觸發。
在感染的過程中,輪狀病毒產生信使核糖核酸來蛋白質生物合成並且進行基因複製。大部分的輪狀病毒蛋白質都堆積在病毒質中,病毒質也是核糖核酸複製的地方,以及雙層構造病毒顆粒組裝的地方。病毒質於病毒感染細胞約兩個小時之內就會快速地在細胞核周圍形成,而組成所謂的“病毒工廠”,這個病毒工廠是由兩個病毒非結構性蛋白質(NSP5與NSP2)所製成。NSP5蛋白質如果因為核糖核酸干擾而被壓抑功能,會明顯地減弱輪狀病毒複製功能。新生的雙層構造病毒顆粒則會移動到內質網,它們將在此處獲得它們第三層外層(由VP7與VP4蛋白質所構成)。最後,這些後代病毒就會經由細胞裂解(lysis)釋放到細胞之外。