聚合酶鏈鎖反應
 聚合酶鏈鎖反應
聚合酶鏈鎖反應DNA聚合酶(DNA polymerase I)最早於1955年發現 ,而較具有實驗價值及實用性的Klenow fragment of E. Coli 則是於70年代的初期由Dr. H. Klenow 所發現,但由於此酶不耐高溫,高溫能使之變性, 因此不符合使用高溫變性的聚合酶鏈式反應。現今所使用的酶(簡稱 Taq polymerase), 則是於1976年從溫泉中的細菌(Thermus aquaticus)分離出來的。它的特性就在於能耐高溫,是一個很理想的酶,但它被廣泛運用則於80年代之後。PCR最初的原始雛形概念是類似基因修復複製,它是於1971年由 Dr. Kjell Kleppe 提出。他發表了第一個單純且短暫性基因複製(類似PCR前兩個周期反應)的實驗。而現今所發展出來的PCR則於1983由 Dr. Kary B. Mullis發展出的,Dr. Mullis當年服務於PE公司,因此PE公司在PCR界有著特殊的地位。Dr. Mullis 並於1985年與 Saiki 等人正式表了第一篇相關的論文。此後,PCR的運用一日千里,相關的論文發表質量可以說是令眾多其它研究方法難望其項背。隨後PCR技術在生物科研和臨床套用中得以廣泛套用,成為分子生物學研究的最重要技術。Mullis也因此獲得了1993年諾貝爾化學獎。
PCR原理
DNA的半保留複製是生物進化和傳代的重要途徑。雙鏈DNA在多種酶的作用下可以變性解鏈成單鏈,在DNA聚合酶與啟動子的參與下,根據鹼基互補配對原則複製成同樣的兩分子拷貝。在實驗中發現,DNA在高溫時也可以發生變性解鏈,當溫度降低後又可以復性成為雙鏈。因此,通過溫度變化控制DNA的變性和復性,並設計引物做啟動子,加入DNA聚合酶、dNTP就可以完成特定基因的體外複製。
但是,DNA聚合酶在高溫時會失活,因此,每次循環都得加入新的DNA聚合酶,不僅操作煩瑣,而且價格昂貴,制約了PCR技術的套用和發展。
發現耐熱DNA聚契約酶--Taq酶對於PCR的套用有里程碑的意義,該酶可以耐受90℃以上的高溫而不失活,不需要每個循環加酶,使PCR技術變得非常簡捷、同時也大大降低了成本,PCR技術得以大量套用,並逐步套用於臨床。
PCR步驟
標準的PCR過程分為三步:
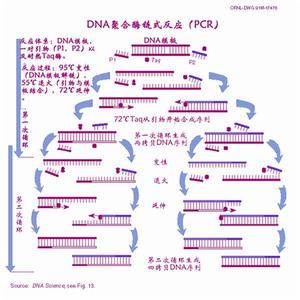
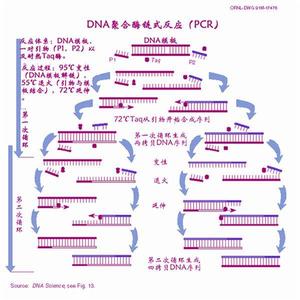
1.DNA變性(90℃-96℃):雙鏈DNA模板在熱作用下,氫鍵斷裂,形成單鏈DNA
2.退火(25℃-65℃):系統溫度降低,引物與DNA模板結合,形成局部雙鏈。
3.延伸(70℃-75℃):在Taq酶(在72℃左右最佳的活性)的作用下,以dNTP為原料,從引物的5′端→3′端延伸,合成與模板互補的DNA鏈。
每一循環經過變性、退火和延伸,DNA含量既增加一倍。如圖所示:
現在有些PCR因為擴增區很短,即使Taq酶活性不是最佳也能在很短的時間內複製完成,因此可以改為兩步法,即退火和延伸同時在60℃-65℃間進行,以減少一次升降溫過程,提高了反應速度。
PCR檢測
PCR反應擴增出了高的拷貝數,下一步檢測就成了關鍵。螢光素(溴乙錠)染色凝膠電泳是最最常用的檢測手段。電泳法檢測特異性是不太高的,因此引物兩聚體等非特異性的雜交體很容易引起誤判。但因為其簡捷易行,成為了主流檢測方法。近年來以螢光探針為代表的檢測方法,有逐漸取代電泳法的趨勢。
PCR反應特點
特異性強
PCR反應的特異性決定因素為:
①引物與模板DNA特異正確的結合;
②鹼基互補配對原則;
③TaqDNA聚合酶合成反應的忠實性;
④靶基因的特異性與保守性。
其中引物與模板的正確結合是關鍵。引物與模板的結合及引物鏈的延伸是遵循鹼基配對原則的。聚合酶合成反應的忠實性及Taq DNA聚合酶耐高溫性,使反應中模板與引物的結合(復性)可以在較高的溫度下進行,結合的特異性大大增加,被擴增的靶基因片段也就能保持很高的正確度。再通過選擇特異性和保守性高的靶基因區,其特異性程度就更高。
靈敏度高
PCR產物的生成量是以指數方式增加的,能將皮克(pg=10- 12)量級的起始待測模板擴增到微克(ug=-6)水平。能從100萬個細胞中檢出一個靶細胞;在病毒的檢測中,PCR的靈敏度可達3個RFU(空斑形成單位);在細菌學中最小檢出率為3個細菌。
簡便、快速
PCR反套用耐高溫的Taq DNA聚合酶,一次性地將反應液加好後,即在DNA擴增液和水浴鍋上進行變性-退火-延伸反應,一般在2~4 小時完成擴增反應。擴增產物一般用電泳分析,不一定要用同位素,無放射性污染、易推廣。
對標本的純度要求低
不需要分離病毒或細菌及培養細胞,DNA 粗製品及RNA均可作為擴增模板。可直接用臨床標本如血液、體腔液、洗嗽液、毛髮、細胞、活組織等DNA擴增檢測。