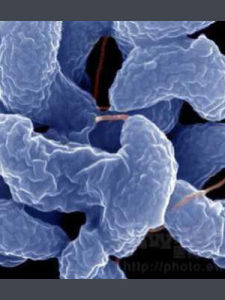
簡介
病原體(pathogen)能引起疾病的微生物和寄生蟲的統稱。微生物占絕大多數,包括病毒、衣原體、立克次體、支原體、細菌、螺鏇體和真菌;寄生蟲主要有原蟲和嚅蟲。病原體屬於寄生性生物,所寄生的自然宿主為動植物和人。能感染人的微生物超過400種,它們廣泛 存在於人的口、鼻、咽、消化道、泌尿生殖道以及皮膚中。每個人一生中可能受到期150種以上的病原體感染,在人體免疫功能正常的條件下並不引起疾病,有些甚至對人體有益,如腸道菌群(大腸桿菌等)可以合成多種維生素。這些菌群的存在還可抑制某些致病性較強的細菌的繁殖,因而這些微生物被稱為正常微生物群(正常菌群)但當機體免疫力降低,人與微生物之間的平衡關係被破壞時,正常菌群也可引起疾病,故又稱它們為條件致病微生物(條件致病病原體)。機體遭病原體侵襲後是否發病,一方面固然與其自身免疫力有關,另一方面也取決於病原體致病性的強弱和侵入數量的多寡。一般地,數量愈大,發病的可能性愈大。尤其是致病性較弱的病原體,需較大的數量才有可能致病。少數微生物致病性相當強,輕量感染即可致病,如鼠疫、天花、狂犬病等。
發現
歷史上首位確定病原體存在的,是1840年代的匈牙利的產科醫生塞麥爾維斯(IgnazSemmelweis)。他發現醫院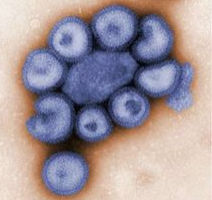 病原體
病原體1846年,匈牙利醫師塞麥爾維斯,套用系統的流行病學調查方法,研究了維也納某醫院產褥熱的流行爆發。當時,他發現在他負責的病區內:由產科醫生和醫學生接生的產婦因產褥熱而死亡的病死率為8.3%;由助產士接生的產婦其病死率僅為2%。經過對感染原因的分析,他認為:醫生們用檢查過因產褥熱而死的屍體的手再去接觸別的產婦,就會使別的產婦也受到傳染,而助產士不作屍解,她們接生的產婦病死率就較低,因此,他要求所有人接觸產婦之前要用漂白粉認真洗手,直到手上無屍體味為止。這一舉措使產褥熱的死亡率由大約10%降至1.5%。
1861年,根據他的臨床觀察和實踐,塞麥爾維斯出版了有關產褥熱的著作。但不幸的是,他的觀點不被當時的權威人士所接受。塞麥爾維斯的措施未得到很好的採納。他的同事拒絕承認他們的手是疾病傳播的工具,他們否認他的理論。塞麥爾維斯的學術價值降低了,他在醫院的特權受到限制。他離開了維也納,前往布達佩斯,從事同樣的觀察,但他又一次被解聘。最後,他甚至被送往精神病院……在極端失望中,他為了證明自己的觀點,於1865年在給一具死
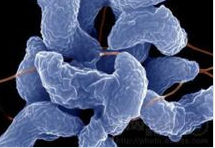 病原體
病原體分級
要確定一種病原體屬於哪一級生物安全水平以實驗操作為基礎,對病原體的操作通常與進行鑑定或分型所需的病原體的生長狀況,以及病原體的數量和濃度有關。如果操作臨床樣本比操作培養樣本對工作人員造成的危險性小,就建議確定較低的生物安全水平級別。另一方面,如果實驗操作涉及體積較大的樣本和(或)濃度較高(“生產數量”)的病原體製備品,或可能產生氣溶膠,或操作本身就有危險,則需要額外的預防措施,並提高初級和二級防擴散裝置的水平。“生產數量”是指感染性病原體的體積或濃度 ,大大超過了通常進行鑑定和分型所需要的量。正如在大規模發酵、抗原和疫苗的生產以及各種商業和研究活動中,感染性病原體的增殖和濃縮需要處理大量“生產數量”級的感染性病原體。大量的感染性病原體可能造成危險性增加,所以對於任何指定的病原體,不可能將“生產數量”限定為有限的體積或濃度。因此,實驗室主管必須對要進行的實驗操作進行評估,選擇與危險性適合的操作技術、防擴散儀器和設施,而不需考慮涉及的病原體的體積和濃度。
有時實驗室主管選擇的生物安全水平應該比建議的級別要高。例如,計畫實驗的獨特性質可能需要較高的生物安全水平(如吸入研究,就需要對實驗產生的氣溶膠進行特殊的防擴散限制);或者實驗室接近需要特殊考慮的區域,也要求較高的生物安全水平(如位於患者護理區附近的診斷實驗室)。同樣,可以採用推薦的生物安全水平來補償由於缺乏某些推薦的保護措施而引起的不足。例如,對於建議採取"級水平的微生物,在設施特徵滿足"級水平的實驗室中進行常規或重複性操作(如為了鑑定、分型及敏感性檢測而進行一種病原體增殖的診斷程式)時,只要嚴格按照建議的標準微生物學操作規程,適合"級水平的特殊操作規程和安全設備進行,也可達到可以接受的安全水平。
在"級水平下,使用"級水平操作技術和規程就能夠安全地對臨床樣本進行常規的診斷工作。在"級設施中,使用"級操作技術和規程可以進行進一步的研究工作(包括共培養、病毒複製研究或涉及濃縮病毒的操作)。
相關知識
在傳染性疾病的病原體中,有些能夠獨立完成生命活動 ,有些則不能獨立完成生命活動。例如:愛滋病的病原體、手足口病的病原體、脊髓灰質炎的病原體就不能獨立完成生命活動;而肺結核的病原體就能夠獨立完成生命活動。對於操作一種特定的病原體或者為動物研究選擇一個恰當的生物安全水平取決於許多因素,其中重要的是:病原體或毒素的毒力、致病性、生物穩定性、傳播途徑,病原體的傳染性,實驗室的性質或職能,涉及病原體的操作步驟和方法,病原體的地方流行性,有效的疫苗和治療方法的可用性。選擇恰當的生物安全水平提供指導。其中包括有關實驗室危害的特殊信息,以及推薦採取的實際操作的保護措施,它們能夠明顯降低實驗室相關性疾病感染的危險性。包括符合下列一條或多條標準的病原體:已被證實對操作感染性物質的實驗室人員具有危害(如B肝病毒、結核桿菌);引起實驗室相關性感染的可能性較高,包括沒有文獻證明的實驗室相關性感染(如外來的蟲媒病毒);或者感染的後果嚴重。
培養和分離
雖較直接檢查法為慢,且較為複雜,但更準確,套用範圍也更廣,幾乎可用於所有的病原體。一般除病毒、衣原體和立克次氏體外,都可用無生命的培養基培養和分離。培養基的種類很多,可根據不同的病原體加以選用。培養分離病原體後,還可進行各種試驗,如發酵試驗、毒力試驗等,這對病原體的進一步鑑定非常重要。病毒、衣原體和立克次氏體缺乏維持生命所必須的各種酶,不能像細菌那樣從培養基中攝取營養物質,利用自己的酶來合成自己所需的各種成分,不能用無生命的培養基培養,而必須接種到有生命的機體內,利用機體的酶來合成它們所需的各種成分。這種方法稱“病毒分離”、“衣原體分離”或“立克次氏體分離”。分離的方法一般有三種:
①組織培養。最簡單常用;
②動物胚胎(如雞胚、鴨胚)接種 ;
③動物接種,如接種小白鼠、豚鼠等。不同的病毒、衣原體或立克次氏體常需要不同的分離方法,分離陽性後也常需進行各種試驗(如血清學試驗等)才能最後判定其種類。病原體的直接檢查常與病原體的培養分離同時進行。
除上述兩種方法外,還有一些特殊的檢查方法。例如對懷疑為的人或動物可取其腦組織檢查特異性包涵體(內格里氏小體)確診;檢查B型肝炎表面抗原可用反向被動血凝法(RPHA)酶聯免疫吸附試驗(ELISA)及放射免疫試驗(RIA)等方法;檢查糞便中的A型肝炎病毒可用免疫電鏡等。還可套用分子雜交或核酸分析的方法來檢驗病人血液、組織或排泄物中的病原體核酸以協助診斷,如血液中及肝組織中的B型肝炎病毒核酸,就可用分子雜交的方法檢測;糞便中的輪狀病毒可用核酸分析的方法來檢測等。由於病原體的各種抗原和病原體的核酸都是病原體的特異性成分,因此如果它們出現陽性也就表示病原體陽性,故這些方法也具有很大的確定診斷的意義。