病因及發病率
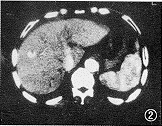 肝肺綜合徵
肝肺綜合徵發病機理
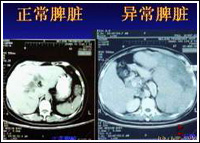 肝肺綜合徵
肝肺綜合徵1 、肺內分流的產生 HPS時由於肝臟功能嚴重受損,腸源性肺血管擴張物質不能被肝細胞滅活造成擴血管物質增多,如胰高血糖素、血管活性腸肽、前列腺素、血管緊張素-2、γ-氨酪酸、5-羥色胺等;或者為肺內皮局部對腸源性擴血管物質敏感性增加及肝功能障礙時,非腸源性肺血管擴張物質增多,如心房利鈉肽、P物質、腫瘤壞死因子、血小板活化因子等。
2、 一氧化氮(NO)在HPS發病機制中的作用 HPS時肺內毛細血管擴張的原因中,一氧化氮(NO)在HPS發病機制中的作用成為研究熱點。HPS時肺內NO生成增多,NO在肝硬化的高動力循環狀態中起重要作用。Cremona觀察到HPS患者呼出氣體中NO含量是正常人的3倍,肝移植術後3月患者呼出氣體中NO含量又恢復正常。HPS患者使用一氧化氮合酶(NOS)抑制劑亞甲藍,患者的低氧血症可能得到迅速糾正。肺內NOS有兩種:誘導型(iNOS)和內皮型(eNOS),Fallon等研究表明HPS肺組織和肺血管多為eNOS活性增強,iNOS活性無明顯變化,說明肺內NO生成增多是肺內eNOS活性增強結果。同時,eNOS活性增強所致低氧血症、過度通氣、A-aPO2增加、對新福林反應降低,些改變都可被NOS抑制劑所逆轉。HPS時肺內eNOS合成增多的原因,與血漿內的內皮素-1(ET-1)、水平增加,及肺內eNOS的合成增多有關。HPS患者體內代謝產物的蓄積也是eNOS合成增多的原因之一。Zhang 等研究發現是eNOS的表達和活性明顯增強,使NO產生增多,同時指出eNOS的表達和活性、循環血中ET-1水平、肺內血管擴張和氣體交換三者之間存在相關性,而iNOS的表達無明顯變化。但Nunes等卻發現iNOS表達增強,使NO產生增多,而引起血管擴張。Liu等研究認為ET-1對肺內eNOS和NO的調節是通過一種ET受體依賴機制發生的,認為在正常情況下,ET-1被血管內皮細胞產生後優先進入血管壁內,與血管平滑肌細胞上的ET受體結合,產生縮血管作用,僅有少量進入管腔內,與血管內皮細胞上的ET受體結合而刺激NO的產生,來拮抗平衡它的縮血管作用;但在HPS時,ET-1可被肝臟過量生成,並可能通過破損的小管緊密連線進入血循環,產生一種內分泌性擴血管作用,優先與肺臟血管內皮細胞上的ET受體結合,增加eNOS的表達和活性,NO產生增多,引起肺內血管擴張。血漿內的ET-1水平和肝臟功能損害的嚴重程度之間有密切關係,可反應肝硬化的程度。目前的共識是:肺血管內吞噬細胞的誘導NOS活性表達升高使肺內NO產生過多,導致HPS發生。
3 、肺通氣/血流比例失調 其它原因是肺外分流、肺內動脈高壓、間質性肺纖維化。通過肝硬化的門靜脈,血液進入食管靜脈至此前縱隔靜脈到達肺靜脈。將低氧的門靜脈血與已氧合的肺靜脈血相混合而導致動脈性低氧血症,可造成心輸出量增加和外周阻力降低。門靜脈和肺靜脈分流的形成是肝硬化患者氧合能力下降的重要原因。
4 、間質性纖維化 肝-肺同受肝炎病毒損傷所致的與免疫反應有關間質性肺纖維性肺泡炎臨床表現為:肝炎後肝硬化致肺受損;肺-動脈瘺;肺動脈高壓;肺纖維化;肺間質水腫;間質性肺炎;盤狀肺不張。
診斷
目前HPS的診斷還沒有統一標準。診斷應以臨床表現為基礎,加以肺血管擴張的影像學證據進行診斷。有人認為肺基底部結節或網狀結節陰影是肺內血管擴張的表現,但這種損害在屍體解剖中很難發現。X線檢查的這種典型表現呈肺基底部的1.3~1.6mm中等大小結節狀或網狀結節狀陰影表現,在慢性肝病患者中的發生率為5%~13.8%,而在HPS患者中可高達46%~100%。但此種表現有人認為並不具有特異性,也可存在於肺纖維化或肉芽腫性疾病,可通過肺功能測定,血管造影或CT檢查等將其區分開。1.Rodriguer-Roisin等於1992年提出了HPS的診斷標準
(1)有慢性肝病存在,可無嚴重的肝功能不全。
(2)無心肺疾病,胸部X線檢查正常或伴有肺基底部結節狀陰影。
(3)肺氣體交換異常,肺泡-動脈氧梯度增加(≥20kPa)。可有低氧血症。
(4)造影劑增強的二維超聲心動圖和(或)肺灌注掃描、肺血管造影證明存在肺血管擴張和(或)肺內血管短路。直立性缺氧、氣短等臨床表現是重要參考指標。
2.ChangSW等於1996年提出本病的診斷標準為
(2)低氧血症,臥位休息呼吸空氣時的肺泡氣-動脈血氧分壓差[P(A-a)O2]≥2.67kPa或立位性缺氧。
(3)肺內血管擴張。
3.Krowka等於1997年認為當患者有門靜脈高壓、蜘蛛痣及杵狀指時,強烈提示本病之診斷,需行相關檢查以便確診。診斷的標準為:
(1)99mTc-MAA掃描、造影劑增強的二維超聲心動圖、肺血管造影檢查等證實存在肺內毛細血管擴張,
(2)存在慢性肝臟疾病和低氧血症PaO2<9.3kPa(70mmHg)。
國內高志等於1998年認為本病的診斷需根據患者有肝脾腫大、腹水、肝掌、蜘蛛痣、勞累性呼吸困難、平臥呼吸及直立性缺氧,胸片顯示肺基底部的間質及血管紋理增多,可呈斑片狀或結節狀、網狀結節狀陰影,CT顯示基底部肺血管擴張、肺血管支增多,血氣分析不一定有嚴重低氧血症,但肺泡-動脈氧梯度增大≥20kPa,肺功能檢查82%有彌散障礙等檢查綜合分析。此外還需行有關分流的檢查,如99mTc-MAA掃描、造影劑增強的二維超聲心動圖、肺血管造影檢查等,但後者不如前兩者敏感,因為肺內小的血管擴張在造影時不一定有表現。Binay等認為肝硬化患者臨床上無發紺、杵狀指及蜘蛛痣,動脈血氣分析、PaO2及肺功能測試均可正常,而氣泡造影超聲心動圖檢查陽性的患者,已出現肺血管擴張,被稱為“亞臨床型”肝肺綜合徵,需引起臨床重視。
實驗室檢查:血氣分析:低氧血症是肝肺綜合徵的基本病理生理改變,因此血氣分析為診斷本病所必需,在沒有原發心肺疾患的肝病患者如出現較明顯的低氧血症則提示本病之診斷。主要表現為:動脈血氧分壓(PaO2)<9.33kPa(70mmHg),肺泡-動脈血氧梯度增大(>4.53kPa或34mmHg),患者由於缺氧可致:如動脈血二氧化碳分壓(PaO2)下降,pH值升高。目前認為PaO2下降是必備條件。但也有人認為肺泡-動脈血氧梯度增大或許更靈敏。
其他輔助檢查:
1.肺功能測定可測定肺活量、最大通氣量、功能殘氣量、肺總量、呼吸儲備容積、R/T、1s用力呼氣容積量、肺一氧化碳彌散量等。在無明顯胸、在。
腹水的肝肺綜合徵患者雖然肺容量及呼氣量可基本正常,但仍有較明顯的彌散量改變,即使校正血紅蛋白後仍明顯異常。一般肝病發展到晚期均有肺功能紊亂,可表現為肺呼氣量下降、呼吸道阻力增加、氣體彌散功能受損等。在肺功能檢查發現有呼氣阻力增加時應做相應檢查;如ɑ-抗胰蛋白酶及表型,以區別肝硬化與肺氣腫同時存2.X線檢查一般患者胸片可無明顯異常,部分患者可出現雙下肺野間質陰影增強,主要表現為:
(2)以下肺野為主的瀰漫性小粟粒狀陰影。
(3)肺動脈擴張。
3.CT可顯示遠端血管擴張,並有大量異常的末梢分支,並能排除引起低氧血症的其他原因,如肺氣腫或肺纖維化。但上述改變均無特異性。現有人提出利用三維重建螺鏇CT進行肺血管影像重建可能是將來確定的熱點,在區分肉眼可見的動-靜脈異常方面與選擇性肺血管造影有相同的準確率。
4.造影劑增強的二維超聲心動圖套用造影劑增強的二維超聲心動圖是證實肺內血管擴張的非侵襲性檢查的首選方法。該方法由Hind和Wong等首次套用於肝硬化患者檢測肺血管擴張。原理是:攪動生理鹽水和靛青綠染料可產生60~90μm的微泡,從周圍靜脈注入後微泡從右心通過擴張的肺血管時沉積在左心房。正常情況下這些微泡在首次通過毛細血管床(直徑8~15μm)時即被吸入肺泡內或被溶解於血液中,不能出現於左心房。該方法依賴微泡在左心房出現的時間區分心內分流和肺內分流。右向左的心內分流可在右心房出現微泡後左心房立即出現微泡,如存在肺內前毛細血管擴張,微氣泡則在離開右心房4~6個心動周期後才出現於左心房。方法是給患者靜脈注射吲哚氰綠後,微氣泡在右心房出現時,二維超聲心動圖上可產生瞬間回聲或雲霧狀陰影。在右心房出現上述超聲變化3~6個心動周期後於左心房也出現同樣變化,即提示有肺內血管擴張。陰性結果基本可以排除肝肺綜合徵的診斷。該方法比動脈血氧分壓及肺掃描更敏感,是目前最合適的篩選方法。但缺點是無法確定病變血管的具體部位,也不能評估其分流程度。近期有人套用經食管二維超聲心動圖更容易檢測這種微小氣泡,並能確定在支氣管中的分布情況,從而用於定位肺內血管擴張是發生在上肺或是下肺。
5.肺血管造影是一種創傷性診斷技術,雖具有一定的危險性,目前仍認為是確定肺血管改變和定位的金標準。不僅可區別肝肺綜合徵性低氧血症與肺栓塞所致的低氧血症,還可為肝肺綜合徵患者選擇外科治療方法提供依據。如果肺血管損害比較孤立則可考慮行選擇性肺動脈栓塞或肺葉切除。其肺血管病變可有如下3種表現:Ⅰ型蜘蛛樣彌散性擴張,多見肝肺綜合徵初期,此期對吸純氧有良好反應;Ⅱ型海綿狀動脈擴張,主要位於肺底部,多見於肝肺綜合徵中期,此期對吸純氧反應有限;Ⅲ型直接肺動、靜脈交通,可見於肺門水平或位於肺底部,呈孤立的蚯蚓狀或團狀陰影,類似動-靜脈畸形,此期臨床缺氧嚴重,發紺明顯,對吸純氧無反應。國內高志等認為肺血管造影的敏感性不如造影增強二維超聲心動圖及下述的肺掃描檢查。也有人將肺血管造影學的類型歸納為如下兩型:Ⅰ型瀰漫性前毛細血管擴張,造影顯示為蜘蛛樣或海綿狀影像(吸入100%氧可以使PaO2上升)。Ⅱ型斷續的局部動脈畸形或交通支形成,造影顯示為孤立的蚯蚓狀或團狀影像(吸入100%氧氣對PaO2幾乎無影響)。缺點是肺血管造影不能顯示小的周圍動靜脈畸形,可產生假陰性結果。
6.99m鎝標記的巨凝白蛋白肺掃描(99mTc-MAA)本方法的原理同微氣泡造影增強的二維超聲心動圖檢查。該方法套用微粒直徑大於20μm的巨凝白蛋白,正常情況下不能通過毛細血管網,所有的肺掃描物質都集中在肺的脈管系統。但有肺血管擴張及肺動-靜脈分流時則可通過並沉積在肝、腦及腎組織中。套用本方法進行核素掃描,能半定量檢測肺內血管擴張及肺內分流程度,並可追蹤病情變化。Abrams等認為對伴有原發性肺疾病的肝硬化HPS患者,肺灌注掃描可以評估HPS對低氧血症的影響程度,幫助決定是否採取肝移植作為治療措施。因為重度原發性肺疾患所致的低氧血症是肝移植的禁忌證,但陰性結果並不能完全排除HPS。
7.靜脈導管測壓術可通過肝和肺靜脈導管術測量肺靜脈壓力梯度(HVPG)、平均肺動脈壓(PAP)和肺毛細血管嵌頓壓(PCWP)等,以了解有無肺動脈高壓等。Binay等對3例肝肺綜合徵患者研究顯示肺血管阻力(PAR)、PCWP值均較氣泡造影超聲心動圖檢查陰性者低。
8.病理改變是診斷HPS最可靠的指標,其基本病理改變為肺血管擴張,表現為瀰漫的大量前毛細血管擴張或不連續的動靜脈交通支形成。暴發性肝衰竭和終末期慢性肝病患者均已證實存在肺內血管擴張,一類結構變化為緊鄰正常肺氣體交換單位的前毛細血管擴張,另一類為遠離肺氣體交換單位的較大動-靜脈交通支。血管鑄型能夠顯示異常血管及其相互間的關係和通路,比大體檢查及組織光學顯微鏡下檢查僅可以辨別出大的分流和血管瘤更便於發現解剖上存在的異常通路(包括小血管的變化)。Fritts等套用放射性核素Kr85溶於水溶性染料中靜脈注射,分析動脈血kr85和染料之間的比例可以估算分流的情況。甲基丙烯酸酯可用於更細緻的血管鑄型研究。
9.其他檢查血生化檢查常顯示肝功能不全,但其程度與肝肺綜合徵的發展並不成比例。肝功能檢查、蛋白分類、病毒學標誌等肝病檢查項目,參見有關內容。另外尚可行胃鏡等以便發現門靜脈高壓的存在。
臨床表現
本病由原發性肝病引起的肺內血管擴張和動脈氧合不足所構成的三聯征,臨床以原發肝病及肺部病變為特點, HPS具有特徵性表現是直立位型呼吸困難、低氧血症、紫紺。1、 原發肝病臨床表現 各種肝病均可發生肝肺綜合徵,以慢性肝病常見,多數病人以各種肝病的表現就診,尚缺乏呼吸系統症狀。其肝病表現由於肝細胞功能損害程度及併發症不同有很大差別,最常見的有肝掌、蜘蛛痣、黃疸、肝脾大、腹水、消化道出血、肝功能異常等。HPS與肝病病因及程度無關,部分肝病穩定的患者也可出現肺功能進行性減退表現,有資料顯示,HPS與食管靜脈曲張、蜘蛛痣相關聯。肺血管擴張(肺蜘蛛痣)常在有皮下蜘蛛痣的肝病患者中發現,易發生低氧血症,皮下蜘蛛痣被認為是有肝外侵犯的標誌。
2、 肺功能障礙的臨床表現 由於患者無原發性心肺疾病,多數在肝病基礎上逐漸出現呼吸系統表現,如發紺、呼吸困難、杵狀指(趾)、直立性缺氧、仰臥呼吸等。進行性呼吸困難是肝肺綜合徵最常見的肺部症狀,發紺是唯一可靠的臨床體徵,仰臥呼吸、直立性缺氧是本症最具特徵性表現。肺部檢查一般無明顯陽性體徵。如肝病患者同時合併其他肺部疾患(如慢支、肺氣腫及肺炎、胸腔積液等)可與肝肺綜合徵同時並存,則可出現明顯的呼吸道症狀,應注意鑑別。
輔助檢查
1、肺功能測定 可測定肺活量、最大通氣量、功能殘氣量、肺總量、呼吸儲備容積、R/T、一秒鐘用力呼氣容積量、肺一氧化碳彌散量等。在無明顯胸、腹水的肝肺綜合徵患者雖然肺容量及呼氣量可基本正常,但仍有較明顯的彌散量改變,即使校正血紅蛋白後仍明顯異常。
2、 動脈血氣分析 HPS時肺泡氧分壓下降,小於70mmHg;SaO 2 下降,小於90% 。直立位和仰臥位時PaO 2 下降,大於10mmHg;A-aPO 2 梯度上升15~20mmHg。呼吸室內空氣和100%氧氣時PaO 2 測定也有重要價值。A-aPO 2 較PaO 2 更靈敏,可作為HPS的主要診斷依據。
3、 對比增強超音波心動掃描 經胸壁超聲心動圖和經食管超聲心動圖可以鑑別病變部位,經食管超聲心動圖比經胸壁超聲心動圖敏感性更高,且與氣體交換障礙有相關性。
4 、HPS肺血管造影兩型 Ⅰ型—瀰漫性前毛細血管擴張:瀰漫分布的蜘蛛樣影像,瀰漫分布的海綿狀或污漬樣影像,吸100%氧氣可以使PaO 2 升高。Ⅱ型—斷續的局部動脈畸形或交通支:孤立的蚯蚓狀或團狀影像,吸100%氧氣對PaO2 無影響。
5 、CT表現 HPS患者胸部CT可顯示肺遠端血管擴張,有大量異常的末梢分支,可提示HPS的存在,但無特異性。胸部CT排除低氧血症的其他原因:肺氣腫、肺纖維化等。薄層CT掃描顯示HPS的肺段動脈直徑與鄰近支氣管直徑的比率明顯大於無低氧血症的肝硬化患者。
6、 胸部X線在HPS時表現無特異性 立位時X線胸片可見到在兩肺基底部顯示間質性浸潤,為血管擴張的陰影,平臥時消失,尚需與肺間質纖維化相鑑別。
診斷
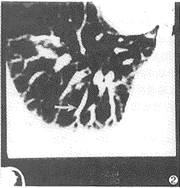 肝肺綜合徵
肝肺綜合徵2、 診斷標準 肝硬化基礎上 微發泡試驗陽性 直立位低氧血症(PaO 2 <70mmHg),即可診斷為HPS。如肝硬化基礎上 微發泡試驗陽性 無直立位低氧血症,說明有肺毛細血管擴張,尚未達到HPS。
症狀
由於肝肺綜合徵是由原發性肝病引起的肺內血管擴張和動脈氧合不足所構成的三聯征,故其臨床表現以原發肝病及肺部病變為主要臨床特點。1.原發肝病:各種肝病均可發生肝肺綜合徵,但以慢性肝病最為常見,尤其是各種原因引起的肝硬化如隱源性肝硬化、酒精性肝硬化、肝炎肝硬化、壞死後肝硬化及膽汁性肝硬化等。多數病人(約占80%)以各種肝病的臨床表現而就診,而此時尚缺乏呼吸系統症狀。其各種肝病的臨床表現由於病因、病程及肝細胞功能損害程度及併發症不同而又有很大差別,其中最常見的臨床表現有肝掌、蜘蛛痣、黃疸、肝脾大、腹水、消化道出血、肝功能異常等,但與肝肺綜合徵之間並無明顯相關性。部分臨床上肝病相當穩定的患者也可出現肺功能進行性減退的臨床表現。有資料顯示如在慢性肝病、肝硬化患者出現蜘蛛痣則提示可能有肺血管床的異常改變。甚至有人認為具有蜘蛛痣體徵者,全身及肺血管擴張明顯,氣體交換障礙嚴重,提示其可能為肺血管擴張的表皮標記。2.肺功能障礙:由於本病患者無原發性心肺疾病。多數(80%~90%)患者是在各種肝病的基礎上逐漸出現呼吸系統表現,如發紺、呼吸困難、杵狀指(趾)、直立性缺氧、仰臥呼吸(platypnea)等。其中,進行性呼吸困難是肝肺綜合徵最常見的肺部症狀,Binay等認為發紺是惟一可靠的臨床體徵,仰臥呼吸、直立性缺氧是本徵最具特徵性的表現。肺部檢查一般無明顯陽性體徵。少數患者(約16%~20%)可在無各種肝病的臨床表現時以運動性呼吸困難為主訴就診,臨床應予以重視,以防誤診。國內高志等曾報導2
例肝肺綜合徵患者以發紺、活動後心慌、氣短為主訴就診的病例,發現同時伴有肝硬化臨床表現(如肝掌、蜘蛛痣、肝脾腫大、腹水),利於本病診斷。如肝病患者同時合併其他肺部疾患(如慢支、肺氣腫及肺炎、胸腔積液等)可與肝肺綜合徵同時並存,則可出現明顯的呼吸道症狀,應注意鑑別。有資料研究表明:肝肺綜合徵患者從最初出現呼吸困難到明確診斷平均需要2~7
年的時間,也有約18%的患者在肝病診斷明確時即已出現呼吸困難。(1)直立性缺氧(orthodeoxidation):患者由仰臥位改為站立位時PaO2降低C>10%。(2)仰臥呼吸(platypnea):患者由仰臥位改為站立位時出現心慌、胸悶、氣短症狀,患者回復仰臥位狀態上述症狀改善。據Krowka
報導,約80%~90%的肝肺綜合徵出現上述兩項表現,是由於肝肺綜合徵患者肺部血管擴張主要分布於中、下肺野,當患者從仰臥位到站立位時,在重力的作用下,中下肺血流增加,加重了低氧血症引起的。雖然上述兩項表現不是肝肺綜合徵所特有,但提示了患者肺內血管系統有明顯異常。如各種肝病患者出現上述兩項表現,應行進一步檢查以便確認。
治療措施
1 、一般治療,包括治療原發病,改善肝臟功能或延緩肝硬化的進程,減低門靜脈壓力,有可能減少肺內右向左分流。2、 吸氧及高壓氧艙,適用於輕型、早期HPS患者,可以增加肺泡內氧濃度和壓力,有助於氧彌散。
3、 栓塞治療適用於孤立的肺動靜脈交通支的栓塞,即肺血管造影Ⅱ型的HPS患者。
4、 經頸靜脈肝內門體分流術(TIPS)可改善HPS患者的氧合作用,PaO2 和肺泡動脈氧分壓差均可明顯改善,患者呼吸困難的症狀好轉。對等待原位肝臟移植的HPS患者,TIPS可降低圍手術期病死率,提高手術安全性。
5、 原位肝移植是HPS的根本性治療方法。可逆轉肺血管擴張。HPS合併的進行性低氧血症可作為肝移植的適應證。Kaspar等最近報導原位肝臟移植後患者的氧分壓、氧飽和度及肺血管阻力均明顯改善。
6、 HPS的藥物治療進展緩慢,療效不滿意。奧曲肽為強效的血管擴張神經肽抑制物,被認為可通過阻斷神經肽、血管活性肽、抑制胰高血糖素等環節,減少HPS患者的肺內動靜脈分流。烯丙哌三嗪能改善慢性阻塞性肺病的通氣/血流比例,能使缺氧肺血管收縮,從而改善肺通氣/血流比例。亞甲藍臨床套用可以增加肺血管阻力和體循環血管阻力,改善HPS患者的低氧血症和高動力循環。藥物治療均未得到公認。
預後
肝硬化患者出現HPS預後較差。因為HPS常使肝臟功能進行性惡化。從出現呼吸困難到確診HPS的時間為(4.8±2.5)年,一旦出現呼吸困難,2.5年的病死率為41% 。尚缺乏有效的藥物來控制HPS的發展,但隨著人類對其發病機制認識深入,尤其是肺內血管擴張機制的闡明可以指導臨床藥物治療方向和新型藥物的開發(如特異性的NOS抑制劑),為HPS的治療提供新途徑。