概述
90年代以來,一種新型靶向給藥體系——結腸靶向給藥系統已受到越來越多的關注,在短短几年中,即形成了多種給
 結腸靶向給藥系統
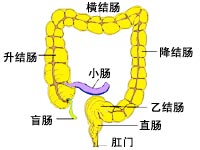
結腸靶向給藥系統結腸的生理結構和功能與藥物的吸收
結腸的主要功能是吸收水分和電解質,使內容物固化為糞便。在結腸內生存著超過400種有益菌群,菌群濃度為1011/ml腸液。這是它區別於消化道其他部分的一個顯著特徵。菌群中以類桿菌和雙歧桿菌為主,另外還有少量梭狀芽孢桿菌、腸桿菌、腸球菌及乳酸桿菌。結腸菌叢產生的酶可催化多種代謝反應,但由於結腸處的無氧環境,這種催化反應與肝臟部位的酶反應有著本質的不同。在肝臟,異源性物質主要被氧化及形成聚集體;而結腸酶主要催化降解反應,水解外物聚集體。目前,被用於結腸給藥的主要有兩大類:偶氮降解酶和糖苷酶。(見後述)。結腸近端的營養物質最豐富,是菌群生長最快的區域,同時由於菌群分解食物殘渣中的纖維素等碳水化合物,產生有機酸、甲烷、氨等物質使結腸近端pH值降低,抑制了蛋白水解酶的活性,較小腸處活性約低20~60倍。至降結腸及直腸等處,由於pH值升高,蛋白水解酶的活性明顯增強,故一般認為升結腸處為蛋白多肽類藥物的最佳給藥部位。
結腸處物質轉運速度緩慢,藥物能在此滯留20~30 h,研究證明藥物分子的大小對其轉運速度影響較大。以不同直徑的片劑進行研究,發現藥物通過結腸的時間與其體積成反比。因此如果希望藥物在該部位發揮長效作用,應減小製劑體積。
結腸的下述特點在藥物吸收方面具有重要意義:① 對於離子型藥物,膜兩側的電位差是吸收的主要動力。② 結腸壁對大分子的屏障作用比小腸處小,因此有利於蛋白多肽類的吸收。③ 大量水分在結腸處吸收,有利於藥物通過溶劑牽引方式被吸收。④ 結腸上皮對表面活性劑較為敏感,故可通過添加吸收促進劑的方法促進大分子藥物吸收。
一般認為,在結腸部位,蛋白多肽類藥物大部分通過細胞間途經吸收。但因結腸處細胞之間結合緊密,且吸收面積遠小於小腸,因此與小腸相比,這一途徑顯得很有限。這一局限性可通過添加吸收促進劑和延長藥物滯留時間加以克服。由於結腸運動緩慢,促吸劑能在該部位達到較高濃度,更有效地發揮作用。據報導,以油酸和膽鹽作吸收促進劑時,降鈣素(Calcitonin,分子量為3527)在結腸的吸收增大了9倍。而胰島素在與促吸劑合用後,使血糖下降了30%~45%。這些研究結果無疑為蛋白多肽類的口服給藥的可行性提供了有力的支持。
近來,有人提出所謂“結腸閉合室”理論,該理論認為,由於結腸段運動極為緩慢,因此可將其視為由所有未被吸收的養分、水分、代謝產物組成的一個封閉“隔室”。藥物可在此處濃集,構成“儲庫”,並由此吸收入血,從而可保證藥物以一種恆定的速度被吸收(零級吸收曲線)。有人研究了苯鈉普利在人及狗的結腸處的吸收。結果表明,藥物均呈零級吸收,當加入吸收促進劑後,藥物的吸收量雖有所增加,但並未改變零級吸收的特點。這一特點可確保蛋白多肽類與促吸劑在該部位始終同步吸收,而使藥物在整個吸收期內處於一種平穩的吸收狀態。
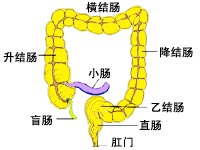
結腸靶向給藥的製劑學手段
結腸靶向給藥即通過藥物傳輸系統,使藥物口服後,在上消化道不釋放,將藥物輸送至人體回盲部後開始崩解或蝕解並釋放出來,而在大腸發揮局部或全身治療作用。根據不同給藥體系的釋藥機理,結腸靶向給藥系統主要可分為三大類。
1 pH依賴型釋藥系統 通常生理條件下,結腸處的pH值較小腸高。利用這一特點,選擇適宜的腸溶材料包裹藥物,
 結腸靶向給藥系統
結腸靶向給藥系統國外曾研製了一種以Eudragit L和S混合物為衣層的膠囊,衣層從進入小腸即開始溶解,但其厚度保證膠囊在到達結腸後方釋出藥物,因此其釋藥機制兼有pH敏感型及時滯型的特點,可通過對衣層的控制使藥物在結腸的不同腸段釋放。臨床試驗證明,在所有受試者中,>90%的人實現了結腸定位。
國內在此方向的研究也取得了可喜的進展。由潮州藥用膠囊廠研製的“通便通膠囊”,其膠殼即採用Eudragit S/L包衣。口服後內含的天然植物油直接在大腸發揮潤滑腸道,軟化糞便,促進腸道蠕動,提高腸內容物推進速度等作用。187例便秘患者使用該製劑,總有效率達93.8% 。
2 時滯釋藥系統 研究表明,儘管胃排空時間極不規則,但在小腸段物質的轉運時間相對要恆定的多,通常為3~4 h。基於此點,設計出了時滯型結腸靶向系統,確保藥物在離開胃部3~4 h後開始釋放。有人設計了一種結腸用滲透泵。這一裝置外包腸溶衣,在到達小腸後衣層開始溶解,在釋藥孔以下為不含藥物的空白層,它完全溶化需3~4 h,當該裝置到達結腸後含藥層才開始發揮作用。 另有一種時滯型釋藥系統採用在固體劑型外先後包羥丙甲基纖維素(HPMC)和腸溶材料的方法。當外層腸溶材料溶解後,HPMC發生凝膠化並逐漸溶蝕。根據這一原理製成的Ketoprofen片採用水/乙醇/聚乙二醇為溶劑製成高粘度的HPMC包衣液,在體外試驗中達到了預期效果。
國外有一種名為“Time ClockTM”的藥品,它在固體藥芯外包上一層由疏水性物質,表面活性劑和水溶性聚合物組成的衣層來達到結腸釋藥的目的。其中一種以卡巴蠟、蜂蠟、司盤和HPMC製成的包衣液,能使藥物在體內約5.5 h後開始崩解。
3 菌群觸髮型釋藥系統又可稱為酶觸發釋藥系統。它是利用結腸菌群產生的酶作用於包裹材料而引起藥物釋放的,因此這一給藥系統具有更強的靶向性。這一類靶向材料是近幾年結腸給藥的一個研究熱點。已開發及合成出十幾種靶向定位材料。
3.1 偶氮化合物 利用結腸菌叢產生的偶氮降解酶,人們曾構想將藥物與載體通過偶氮鍵連線,以賦予其結腸靶向性。但因合成方法複雜,藥物與載體之間只能一一對應而限制了用藥劑量,且反應副產物的存在亦局限了這種前藥的套用。1986年,Saffran等合成了一種聚苯乙烯和羥乙基異丁烯酸交聯而成的高分子化合物,將它作為衣層製成胰島素和加壓素膠囊及小丸。經動物試驗證明,膠囊及小丸均在結腸部位被菌群降解而釋出藥物。此後,Mooter合成了羥乙基異丁烯酸(HEMA)、甲基異丁烯酸(MMA)、HEMA與MMA的四聚物及異丁烯酸(MA)構成的復聚物,以其作為膠囊的包衣材料,研究了偶氮化合物的膨脹性和酶降解性的關係。體外試驗表明,偶氮化合物的降解取決於它們的膨脹程度。當介質pH值升高時,偶氮化合物發生不同程度的膨脹,至回盲結合部及大腸時,膨脹程度已足以使細菌能輕易降解偶氮雙鍵。以MA為衣層的異丁苯丙酸在19 h後藥物釋放達(98.7±1.1)%,而對照組僅為(26.2±4.9)% 。
3.2 多糖類大分子 作為一類新開發的結腸靶向材料,正引起越來越多的關注。因其具有不可比擬的優越性:① 在消化道上部(胃、小腸內)通常不被吸收,而能被結腸細菌專一性降解。② 作為天然化合物,不僅價廉易得,而且其安全性已經長期使用證實並多已被作為藥用輔料收載入各國藥典。
但這類化合物往往是水溶性大分子。因此需要對其結構進行改造或形成衍生物,在不削弱其靶向性的前提下,提高疏水性,以便更有效地保護藥物。這類化合物主要有:直鏈澱粉、葡聚糖、果膠、瓜耳豆膠、硫酸軟骨素等。
直鏈澱粉是澱粉的主要組成成分。它可在一定條件下膠化形成衣層。這一衣層可抵禦胰α-澱粉酶的作用,能被結腸細菌產生的澱粉酶降解。Milojevic等研究了用直鏈澱粉包衣的微丸的結腸定位性。為克服直鏈澱粉在胃腸液中膨脹的缺點,他們在包衣液內加入了水不溶性的乙基纖維素。採用這一包衣液製成的5-ASA微丸在體外溶出中經12 h不溶。當溶出介質中加入結腸內容物後,藥物開始釋放。這一劑型在室溫下放置一年仍很穩定。Hovgoard等將葡聚糖與二異氰酸交聯後形成的化合物製成水凝膠,在體內及體外試驗中證明這一凝膠均能被結腸部位特有的葡聚糖酶降解,並發現調節凝膠的化學組成可以控制凝膠在消化液中的膨脹性和機械強度,保證藥物在胃及小腸內不釋放或少量釋放。他們利用這一凝膠製成直徑6.6 mm的氫化可的松片。體外試驗表明:藥物的釋放速率主要受凝膠的交聯密度和葡聚糖酶的控制並與藥物本身的親水性有關。
果膠是存在於植物細胞壁中的一類大分子物質。經研究發現結腸內菌群可產生果膠酶特異性降解這一大分子物質。研究人員採用果膠作為片劑衣層,6名受試者口服該片後,以γ-閃射技術跟蹤其體內情況。結果表明,所有藥片均在結腸崩解。為提高果膠的疏水性,Rubinstein等將果膠與鈣鹽製成難溶性的果膠鈣,將其與吲哚美辛混合和壓成的片劑在pH7的緩衝液中24 h的釋放量<10%,而當進入結腸內容物後,24 h內藥物釋放接近60%。進一步研究表明,果膠鈣中Ca2+的含量與其疏水性直接相關:當Ca2+含量增加時,形成的產物疏水性更強;實驗發現,各種可降解果膠的酶其活性的激發及維持均離不開Ca2+。因此,儘管材料的疏水性隨Ca2+含量增大而增強,卻更易被酶降解。
殼聚糖是一種氨基多糖,是由廣泛存在於海洋生物的甲殼中甲殼質脫乙醯化的產物,近年來作為一種緩控釋材料得到廣泛套用。殼聚糖具有很好的生物相容性,其分子中的糖苷鍵亦能為結腸酶降解,故而也可作為結腸靶向材料。殼聚糖易溶於酸,而對鹼性環境有較強的抵抗力。有人用戊二醛為交聯劑製成交聯殼聚糖,可減小其在酸中的溶解度。以腸溶衣包裹的殼聚糖含藥小球可以保護藥物安全通過胃和小腸,到達結腸後,隨衣層溶解,殼聚糖被酶降解,藥物隨之釋放出來。
瓜爾豆膠是另一種可被結腸菌群降解的多糖。但因其親水性和膨脹性過大致使藥物在小腸即開始釋放。為提高其疏水性,採用瓜爾豆膠與丙烯酸樹脂的混合物對片劑進行包衣。體外試驗證明,該衣層不僅疏水性增強,且仍能為結腸細菌所降解。
結語
結腸因其特殊的生理環境而特別適用於作為某些特殊疾病和藥物治療的靶向器官。近年來結腸靶向給藥系統在製劑學和靶向材料研究等方面取得了很大進展,其中一些已用於臨床並形成商品,顯示了可喜的前景。結腸靶向給藥對便秘、結腸炎、大腸癌等腸道疾病的治療以及蛋白多肽藥物的口服給藥都具有重要意義,是一個極具前景的新的研究領域。這一給藥系統在短短十幾年中已發展成了pH依賴型、時滯釋藥型、菌群觸髮型等多種給藥體系。但也仍存在一定的局限性,由於消化道的pH值及轉運時間受食物、性別、疾病等個體因素影響較大。因此前兩種劑型給藥後的定位性較差。現在最被看好的菌群觸髮型給藥體系,存在的關鍵問題是如何提高高分子材料的疏水性和降低膨脹度問題。另外,如何使藥物在細菌作用下儘快釋放出來以及促進機體吸收,仍是需要製劑工作者進一步研究的課題。