簡介
靶向製劑亦稱靶向給藥系統(Targetingdrugdeliverysystem,TDDS),
 主動靶向
主動靶向是通過載體使藥物選擇性的濃集於病變部位的給藥系統,病變部位常被形象的稱為靶部位,它可以是靶組織、靶器官,也可以是靶細胞或細胞內的某靶點。靶向製劑不僅要求藥物到達病變部位,而且要求具有一定濃度的藥物在這些靶部位滯留一定的時間,以便發揮藥效,成功的靶向製劑應具備定位、濃集、控釋及無毒可生物降解等四個要素。由於靶向製劑可以提高藥效、降低毒性,可以提高藥品的安全性、有效性、可靠性和病人用藥的順應性,所以日益受到國內外醫藥界的廣泛重視。
特點及要素
特點
①可以提高藥效;
②降低毒性;
③可以提高藥物的安全性,有效性;
 脂質體
脂質體④可以提高病人用藥的順應性。
要素
①定位;
②濃集;
③控釋;
④無毒,可生物降解。
分類
靶向製劑分類藥
物的靶向從到達的部位講可以分為三級,第一級指到達特定的靶組織或靶器官,第二級指到達特定的細胞,第三級指到達細胞內的特定部位。從方法上分類,靶向製劑大體可分為以下三類:
被動靶向製劑
被動靶向製劑(passivetargetingpreparation)即自然靶向製劑。載藥微粒被單核-巨噬細胞系統的巨噬細胞(尤其是肝的Kupffer細胞)攝取,通過正常生理過程運送至肝、脾等器官,若要求達到其他的靶部位就有困難。被動靶向的微粒經靜脈注射後,在體內的分布首先取決於微粒的粒徑大小。通常粒徑在2.5~10μm時,大部分積集於巨噬細胞。小於7μm時一般被肝、脾中的巨噬細胞攝取,200~400nm的納米粒集中於肝後迅速被肝清除,小於10nm的納米粒則緩慢積集於骨髓。大於7μm的微粒通常被肺的最小毛細血管床以機械濾過方式截留,被單核白細胞攝取進入肺組織或肺氣泡。除粒徑外,微粒表面性質對分布也起著重要作用。
單核-巨噬細胞系統對微粒的攝取主要由微粒吸附血液中的調理素(opsonin,包括igg,補體c3b或纖維結合素fibronectin)和巨噬細胞上有關受體完成的:吸附調理素的微粒粘附在巨噬細胞表面,然後通過內在的生化作用(內吞、融合等)被巨噬細胞攝取。微粒的粒徑及其表面性質決定了吸附哪種調理素成分及其吸附的程度,也就決定了吞噬的途徑和機制。被動靶向製劑的載藥微粒包括:脂質體、乳劑、微囊和微球、納米囊和納米球。
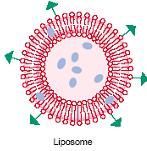
①脂質體
系指將藥物包封於類脂質的雙分子層內形成的微型泡囊,為類脂小球或液晶微囊。
②靶向乳劑
乳劑的靶向性在於它對淋巴的親和性。
油狀藥物或親脂性藥物製成的O/W或O/W/O靜脈復乳,使得原藥物濃集於肝、脾、腎等巨噬細胞豐富的組織器官。③微囊和微球
指藥物溶解或分散在輔料中形成的微小球狀實體或囊泡。
④納米囊和納米球
納米囊屬藥庫膜殼型,納米球屬基質骨架型。粒徑10~1000nm在水中形成近似膠囊的的溶液。可穿透細胞壁打靶點,不阻塞血管,可靶向肝、脾和骨髓。
主動靶向製劑
主動靶向
主動靶向製劑(activetargetingpreparation)是用修飾的藥物載體作為"飛彈",將藥物定向地運送到靶區濃集發揮藥效。如載藥微粒經表面修飾後,不被巨噬細胞識別,或因連線有特定的配體可與靶細胞的受體結合,或連線單克隆抗體成為免疫微粒等原因,而能避免巨噬細胞的攝取,防止在肝內濃集,改變微粒在體內的自然分布而到達特定的靶部位;亦可將藥物修飾成前體藥物,即能在活性部位被激活的藥理惰性物,在特定靶區被激活發揮作用。如果微粒要通過主動靶向到達靶部位而不被毛細血管(直徑4~7μm)截留,通常粒徑不應大於4μm。
物理化學靶向製劑
物理化學靶向製劑(physicalandchemicaltargetingpreparation)套用某些物理化學方法可使靶向製劑在特定部位發揮藥效。如套用磁性材料與藥物製成磁導向製劑,在足夠強的體外磁場引導下,通過血管到達並定位於特定靶區;或使用對溫度敏感的載體製成熱敏感製劑,在熱療的局部作用下,使熱敏感製劑在靶區釋藥;也可利用對ph敏感的載體製備ph敏感製劑,使藥物在特定的ph靶區內釋藥。用栓塞製劑阻斷靶區的血供和營養,起到栓塞和靶向化療的雙重作用,也可屬於物理化學靶向。
中藥靶向製劑的套用
脂質體靶向給藥系統
脂質體是指將藥物包封於類脂雙分子層形成的藥膜中間所製成的超微型藥物製劑。作為藥物載體具有載藥靶向運行、延長療效、避免耐藥性、減少給藥劑量、降低不良反應、改變給藥途徑等優點。
常規的脂質體脂質體主要由磷脂或磷脂和膽酸組成,改造過的脂質體通過選擇不同磷脂或投入其它成分而改變成熱敏、pH敏和陽離子脂質體等;對脂質體表面進行修飾得到免疫和長循環脂質體等;還可以運用磁性製劑和前體製劑的原理製備磁性脂質體和前體脂質體。如用超聲法或高壓乳化法等製成黃芩脂質體分散液,再用流動床將它用多種糖芯材料(山梨酸、葡萄糖等)作切線噴霧製成黃芩脂質體粉末,有助於提高脂質體的穩定性。另外還有青蒿素、銀杏葉、喜樹鹼和長春新鹼等脂質體的報導,而採用熔融法製備的雙參相口服液,也是中國、外首次關於中藥複方脂質體的報導。研究的主要內容是脂質體雙層膜的組成及製備工藝,提高脂質體包封率、穩定性及其靶向分布、對靶細胞作用等方面。
微囊、微球靶向給藥系統
微囊是利用天然或合成高分子材料或共聚物(囊膜材料),將藥物包裹而成的一種新的劑型。囊膜有隔離外界與藥物接觸作用,可防止藥物氧化、水解和揮發,掩蓋不良氣味,減少複方製劑中的配伍禁忌。中國研製的中藥揮髮油類微囊已有10餘種,如可提高穩定性的芥油微囊,掩蓋不良臭味的蒜素微囊等,也可製備特殊性能微囊(磁性微囊、pH敏感微囊)起到靶向釋藥作用。
微球是指將藥物分子溶解或分散在輔料中形成的微小球狀實體,多用生物降解材料為載體,如蛋白類(明膠、白蛋白等)、糖類(瓊脂糖、澱粉、葡萄糖、殼聚糖等)、合成聚脂類(如聚乳酸、丙交酯乙脂類共聚物等),而以二乙胺基乙基葡萄糖、血清白蛋白、可降解澱粉製成的微球具有生物黏附性。
靶向微球可分為三類:普通注射微球、栓塞性微球、磁性微球。如以高分子生物降解聚碳酸酯[poly(DTC-co-TMC)90∶10]為載體,製備出一種新型的含腫瘤壞死因子(INF)並具有強烈磁性的聚碳酸酯磁性微球。以殼聚糖為載體製成的金雀異黃素(Genistein,4′,5,7-三羥基異黃酮)微球膠囊製劑,對肺與脾的選擇性強,並且藥物在較長時間內保持一定的血藥濃度,具有一定的緩釋性。
結腸靶向黏附給藥系統
結腸靶向黏附給藥系統是20世紀90年代後期發展起來的新型給藥系統,該系統通過特殊控釋技術,使藥物轉運到回盲部後,才開始崩解或釋出載體微粒,並使載體在一定時間範圍內黏附於結腸膜表面,達到定位釋藥與黏附的雙重目的。結腸靶向黏附給藥系統在中藥方面的運用還處在研究階段,如大黃的瀉下作用主要是由於游離蒽醌對大腸的作用,將大黃提取、濃縮、乾燥,製成大黃瀉下的大腸靶向製劑,就可以提高療效和降低用量。又如以中藥組方進行藥物提取,精製後製成微丸,選取經特殊處理的果膠為包衣材料,考察其在人體結腸內的定位、釋藥情況,為中藥結腸給藥提供了依據。
複合型乳劑
藥物製成復乳後,可以達到緩釋、控釋目的,而且在體內具有淋巴系統的定向性,可選擇性地分布於肝、肺、腎、脾等網狀內皮系統較豐富的器官中。復乳中的小油滴與癌細胞有較強的親和力,可成為良好的靶向給藥系統,復乳也可作為多肽、蛋白質等水溶性藥物的載體,避免藥物在胃腸道中失活,增加穩定性。目前中藥復乳製劑雖不多見,但從長遠看,乳劑尤其是復乳有可能成為抗癌藥物靶向輸送的重要工具之一。如用PEG、紫杉醇和聚乙二醇-二硬脂醯磷脂醯乙醇胺(PEG-DSPE)的氯仿溶液在氮氣流下減壓成膜,加入玉米油經水化超聲處理後,通過微流化器使其微乳化,製得的紫杉醇微乳。康萊特靜脈注射乳劑具有靶向作用,直接有效抑制癌細胞,同時能提高機體整體免疫功能,並有良好的鎮痛功能,且無不良反應。
納米靶向給藥系統
納米粒是由天然高分子物質(如白蛋白、明膠、乙基纖維素等)或合成高分子物質(如聚氰基丙烯酸烷酯(PACA)、丙烯酸共聚物等)製成粒徑為nm級固態膠體粒子,分為藥庫膜殼型納米囊和基質骨架型納米粒。這類載體製劑的優點是可生物降解、低免疫性、製劑形成多樣化、包封率高、穩定性好。如用乳化法製備了125I-白蛋白-黃芪多糖納米粒(168±62)nm,研究表明小鼠口服後主要分布在肝、脾、肺中。採用熱融分散技術製備的喜樹鹼固體脂質體納米,動物實驗表明,該製劑在體內有良好的靶向性。最新的研究表明,甘油三酯和油類連合的固液二相載藥系統,比傳統的硬脂酸載藥系統具有更大的載藥量,並且更適合於臨床運用。
中藥靶向製劑存在問題
載藥量小
穩定性較差
製劑技術中等
藥動學模型缺乏
質量評價 指標、
標準不成熟
1中藥靶向製劑在中國還僅處於實驗階段目前,中藥靶向製劑的研究主要是在單味藥方面,而中藥有效部位及複方研製的靶向製劑屈指可數,這與制定質量標準及製劑工藝難度大有關。因此,應首先選擇藥味較少、作用顯著、著名中藥複方來作為中藥複方靶向製劑研究的突破口。
2中藥靶向製劑目前還存在一些有待研究的問題如何較恰當地描述中藥靶向製劑體內、外釋放過程,是中藥靶向製劑質量評價的重點和難點,需要運用先進的儀器和分析方法,對其有效成分進行藥動學參數的測定。
3中藥新劑型和新技術的開展是中藥現代化的核心內容要真正深入研究並開發出臨床可用的靶向製劑,只靠製劑學的知識和技術是遠遠不夠的,還需要有組織地開展多學科合作。套用新技術開發中藥新劑型,特別是靶向製劑,是中醫藥今後發展的一個重要課題,也是中藥國際化的關鍵。
靶向性評價
藥物製劑的靶向性可由以下三個參數來衡量:
1.相對攝取率(re)
re=(auci)p/(auci)s
式中,auci-由濃度-時間曲線求得的第i個器官或組織的藥時曲線下面積;腳標p和s分別表示藥物製劑及藥物溶液。re大於1表示藥物製劑在該器官或組織有靶向性,re愈大靶向效果愈好;等於或小於1表示無靶向性。
2.靶向效率(te)
te=(auc)靶/(auc)非靶
式中,te-表示藥物製劑或藥物溶液對靶器官的選擇性。te值大於1表示藥物製劑對靶器官比某非靶器官有選擇性;te值愈大,選擇性愈強;藥物製劑的te值與藥物溶液的te值相比,說明藥物製劑靶向性增強的倍數。
3.峰濃度比(ce)
ce=(cmax)p/(cmax)s
式中,cmax為峰濃度,每個組織或器官中的ce值表明藥物製劑改變藥物分布的效果,ce值愈大,表明改變藥物分布的效果愈明顯。
發展趨勢
靶向製劑與靶細胞受的結合
基因治療(genetherapy)是近年來發展起來的一種補充人體缺失基因或關閉異常基因的新療法,對於惡性腫瘤、先天性遺傳病、愛滋病、糖尿病及心血管疾病等的治療具有重大價值。
研究攜帶治療基因片段或雜合體重組DNA質粒,保持其不被核酸酶降解,順利地轉導入人體靶位的載體將是21世紀初靶向給藥製劑研究領域的重要課題。
參考文獻
[1]梅景良;注射用藥的靶向製劑[J];福建畜牧獸醫;1998年03期.
[2]溫濤;微乳液在中藥納米載體藥物合成和毒品分析中的套用研究[D];清華大學;2005年.
[3]朱銀燕,張高勇,洪昕林,楊恆權;膠體體系中合成納米膠囊的研究進展[J];日用化學工業;2003年06期.[4]吳瓊珠,王冬燕;靶向給藥系統[J];南京軍醫學院學報;1995年02期.
[5]蘇秀琴,孟祥文;藥物微球的基礎研究與臨床套用[J];山西醫科大學學報;1999年03期.
[6]張玉,王凱平,譚紅艾,劉濤;肝靶向藥物的研究進展[J];醫藥導報;2002年04期.
[7]任百祥,周曉光;DNA靶向藥物作用機制及發展趨勢[J];醫藥導報;2003年09期.
[8]唐曉蕎,劉宏,楊祥良;雙親性環糊精納米粒的製備和套用[J];中國醫藥工業雜誌;2003年11期.
