簡介
pH是1909年由丹麥生物化學家SorenPeterLauritzSorensen提出。p來自德語Potenz(meanspotency,power),意思是濃度、力量,H(hydrogenion)代表氫離子(H);有時候pH
 氫離子濃度指數
氫離子濃度指數也被寫為拉丁文形式的Pondushydrogenii(Pondus=壓強、壓力,hydrogen=氫)。
如果某溶液所含氫離子的濃度為每升0.00001摩爾(mol/L),它的氫離子濃度指數就是5,計算方法為-lg[濃度值]。
與其相反,如果某溶液的氫離子濃度指數為5,他的氫離子濃度為0.00001摩爾每升(mol/L),計算方法為10^(-濃度指數)
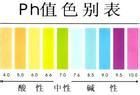
氫離子濃度指數(pH值)一般在0-14之間,在常溫下(25℃時),當它為7時溶液呈中性,小於7時呈酸性,值越小,酸性越強;大於7時呈鹼性,值越大,鹼性越強。
當溫度升高,中性對應的pH值逐漸減小【當在95℃時,中性對應的pH值=6,pH小於6時呈酸性,值越小,酸性越強;大於6時呈鹼性,值越大,鹼性越強。此時,氫離子濃度指數在0-12之間。
pH是溶液中氫離子活度的一種標度,也就是通常意義上溶液酸鹼程度的衡量標準。pH值越趨向於0表示溶液酸性越強,反之,越趨向於14表示溶液鹼性越強,在常溫下,pH=7的溶液為中性溶液。
由於實際中的溶液不是理想溶液,所以僅僅用H+濃度是不可以準確測量的,因此也無法準確計算得到溶液的pH。故而應當採用H+活度,即pH=-lgaH+=-lgγ·cH+。這樣從理論上講只要知道氫離子的活度aH+就可以得到溶液的準確pH。
在常溫下(25℃時),pH>7為鹼性pH<7為酸性。
積常數
為了便於理解和說明pH,首先闡述一下水的電離和水的離子積常數。
 氫離子濃度指數
氫離子濃度指數水的電離:水是一種極弱的電解質,可以發生微弱的電離,其電離方程式為:H2O+H2O≒H3O++OH-,簡寫為H2O≒H++OH-,是一個吸熱過程。水的電離受溫度影響,加酸加鹼都能抑制水的電離。水的電離是水分子與水分子之間的相互作用而引起的,因此極難發生。實驗測得,25℃時1L純水中只有1×10^(-7)mol的水分子發生電離。由水分子電離出的H+和OH-數目在任何情況下總相等。25℃時,純水中[H+]=[OH-]=1×10^(-7)mol/L.
水的離子積常數:[H+]·[OH-]=K(W),其中K(W)稱作水的離子積常數,簡稱水的離子積;[H+]和[OH-]是分別是指整個溶液中氫離子和氫氧根離子的總物質的量濃度.K(W)只隨溫度變化而變化,是溫度常數.如25℃,[H+]=[OH-]=1×10^(-7)mol/L,K(W)=1×10^(-14);100℃時,[H+]=[OH-]=1×10^(-6)mol/L,K(W)=1×10^(-12).
水的pH值
pH值是水溶液最重要的理化參數之一。凡涉及水溶液的自然現象。化學變化以及生產過程都與pH值有關,因此,在工業、農業、醫學、環保和科研領域都需要測量pH值。
水的pH值是表示水中氫離子活度的負對數值,表示為:
pH=-lgaH+
pH值有時也稱氫離子指數,由於氫離子活度的數值往往很小,在套用上很不方便,所以就用pH值這一概念來作為水溶液酸性、鹼性的判斷指標。而且,氫離子活度的負對數值能夠表示出酸性、鹼性的變化幅度的數量級的大小,這樣套用起來就十分方便,並由此得到(在25℃下):
⑴中性水溶液,pH=7
⑵酸性水溶液,pH<7,pH值越小,表示酸性越強;
⑶鹼性水溶液,pH>7,pH值越大,表示鹼性越強。
溶液pH
含義
 氫離子濃度指數
氫離子濃度指數溶液酸性、中性或鹼性的判斷依據是:[H+]和[OH-]的濃度的相對大小.在任意溫度時溶液[H+]>[OH-]時呈酸性,[H+]=[OH-]時呈中性,[H+]<[OH-]時呈鹼性.但當溶液中[H+]、[OH-]較小時,直接用[H+]、[OH-]的大小關係表示溶液酸鹼性強弱就顯得很不方便.為了免於用氫離子濃度負冪指數進行計算的繁瑣,丹麥生物化學家澤倫森(Soernsen)在1909年建議將此不便使用的數值用對數代替,並定義為"pH"。數學上定義pH為氫離子濃度的常用對數負值,即:pH=-lg[H+].
在標準溫度(25℃)和壓力下,pH=7的水溶液(如:純水)為中性,這是因為水在標準溫度和壓力下自然電離出的氫離子和氫氧根離子濃度的乘積(水的離子積常數)始終是1×10^(-14),且兩種離子的濃度都是1×10^(-7)mol/L。pH值小說明H+的濃度大於OH-的濃度,故溶液酸性強,而pH值增大則說明H+的濃度小於OH-的濃度,故溶液鹼性強。所以pH值愈小,溶液的酸性愈強;pH愈大,溶液的鹼性也就愈強。
通常pH值是一個介於0和14之間的數,當pH<7的時候,溶液呈酸性,當pH>7的時候,溶液呈鹼性,當pH=7的時候,溶液呈中性.但在非水溶液或非標準溫度和壓力的條件下,pH=7可能並不代表溶液呈中性,這需要通過計算該溶劑在這種條件下的電離常數來決定pH為中性的值。如373K(100℃)的溫度下,pH=6為中性溶液。
pH計算
在pH的計算中[H+]指的是溶液中氫離子的物質的量濃度(有時也被寫為[H3O+],水合氫離子的物質的量濃度),單位為mol/L(摩爾/升),在稀溶液中,氫離子活度約等於氫離子的濃度,可以用氫離子濃度來進行近似計算。
pH測定
有很多方法來測定溶液的pH值: 1.使用pH指示劑。在待測溶液中加入pH指示劑,不同的指示劑根據不同的pH值會變化顏色,根據指示劑的研究就可以確定pH的範圍。滴定時,可以作精確的pH標準。
2.使用pH試紙。pH試紙有廣泛試紙和精密試紙,用玻璃棒蘸一點待測溶液到試紙上,然後根據試紙的顏色變化對照標準比色卡可以得到溶液的pH。pH試紙不能夠顯示出油份的pH,原因是pH試紙以氫鐵製成並以氫鐵來測定待測溶液的pH值,而油中不含氫鐵。
3.使用pH計。pH計是一種測定溶液pH值的儀器,它通過pH選擇電極(如玻璃電極)來測定出溶液的pH。pH計可以精確到小數點後兩位。
此外還有許多其他更為先進更為精確的pH值測算方法和手段。
節選自《水質PH值的測定玻璃電極法》
1適用範圍
1.1本法適用於飲用水、地面水及工業廢水pH值的測定。
1.2水的顏色、濁度、膠體物質、氧化劑、還原劑及高含鹽量均不干擾測定;但在pH<1的強酸性溶液中,會有所謂"酸誤差",可按酸度測定;在pH>10的鹼性溶液中,因有大量鈉離子存在,產生誤差,使讀數偏低,通常稱為"鈉差"。消除"鈉差"的方法,除了使用特製的"低鈉差"電極外,還可似選用與被測溶液的pH值相近似的標準緩衝溶液對儀器進行校正。
溫度影響電極的電位和水的電離平衡。須注意調節儀器的補償裝置與溶液的溫度一致,並使被測樣品與校正儀器用的標準緩衝溶液溫度誤差在±1℃之內。
2定義
pH是從操作上定義的。對於溶液x,測出伽伐尼電池參比電極1KC1濃溶液H溶液×|H2|pt的電動勢EX。將未知pH(X)的溶液X換成標準pH溶液S,同樣測出電池的電動勢ES,則
pH(X)=pH(S)+(Es—Ex)F/(RTIn10)
3原理
pH值由測量電池的電動勢而得。該電池通常由飽和甘汞電極為參比電極,玻璃電極為指示電極所組成。在25℃,溶液中每變化1個pH單位,電位差改變為59.16毫伏,據此在儀器上直接以pH的讀數表示。溫度差異在儀器上有補償裝置。
pOH
pOH(氫氧根離子濃度指數)是和pH相對應的表示溶液中氫氧根離子活度的概念,定義如下:
當在298K(25℃)的時候,水的離子積Kw=[H][OH]=10^(-14)因為logKw=log[H]+log[OH],所以此時pOH=14-pH。
pOH值指的是溶液的鹼度,以溶液中OH-(氫氧根離子)濃度來表示,與pH所表示的溶液酸度相對應,pOH等於氫氧根離子的濃度的負常用對數,
即:pOH=-lg[OH-].
根據pOH值可以計算出溶液中氫氧根離子的濃度。
25攝氏度的水溶液中,pOH與pH值關係:
pH+pOH=14.0
所以,pH=14.0-pOH
在計算鹼性溶液的pH時必須先計算出溶液的pOH,再根據pH=14.0-pOH計算出溶液的pH值。

