原理
 PH計
PH計 HO+ HO=HO+ OHˉ
,由於水合氫離子(HO)的濃度是與氫離子(H)濃度等同看待,上式可以簡化成下述常用的形式:
HO=H+ OHˉ
此處正的氫離子,人們在化學中表示為“H離子”或“氫核”。水合氫核表示為“水合氫離子”。負的氫氧根離子稱為“氫氧化物離子”。
利用質量作用定律,對於純水的離解可以找到一平衡常數加以表示:
K=HO×OH————HO
由於水只有極少量被離解,因此水的質量摩爾濃度實際為一常數,並且有平衡常數K可求出水的離子積KW。
KW=K×HO KW= HO·OH-=10·10=10mol/l(25℃)
也就是說對於一升純水在25℃時存在10摩爾HO離子和10摩爾OHˉ離子。
在中性溶液中,氫離子H和氫氧根離子OHˉ的濃度都是10mol/l。如:
假如有過量的氫離子H,則溶液呈酸性。酸是能使水溶液中的氫離子H游離的物質。同樣,如果使OHˉ離子游離,那么溶液就是鹼性的。所以,給出H值就足以表示溶液的特性,呈酸性還是鹼性,為了免於用此分子濃度負冥指數進行運算,生物學家澤倫森(Soernsen)在1909年建議將此不便使用的數值用對數代替,並定義為“pH值”。數學上定義pH值為氫離子濃度的常用對數負值。即pH=-log[H]。
因此,pH值是離子濃度以10為底的對數的負數:
改變50m的水的pH值,從pH2到pH3需要500L漂白劑。然而,從pH6到pH7隻需要50L的漂白劑。
測量pH值的方法很多,主要有化學分析法、試紙法、電位法。現主要介紹電位法測得pH值。
電位分析法所用的電極被稱為原電池。原電池是一個系統,它的作用是使化學反應能量轉成為電能。此電池的電壓被稱為電動勢(EMF)。此電動勢(EMF)由二個半電池構成,其中一個半電池稱作指示電極,它的電位與特定的離子活度有關,如H;另一個半電池為參比半電池,通常稱作參比電極,它一般是測量溶液相通,並且與測量儀表相連。
例如,一支電極由一根插在含有銀離子的鹽溶液中的一根銀導線製成,在導線和溶液的界面處,由於金屬和鹽溶液二種物相中銀離子的不同活度,形成離子的充電過程,並形成一定的電位差。失去電子的銀離子進溶液。當沒有施加外電流進行反充電,也就是說沒有電流的話,這一過程最終會達到一個平衡。在這種平衡狀態下存在的電壓被稱為半電池電位或電極電位。這種(如上所述)由金屬和含有此金屬離子的溶液組成的電極被稱為第一類電極。
此電位的測量是相對一個電位與鹽溶液的成分無關的參比電極進行的。這種具有獨立電位的參比電極也被稱為第二電極。對於此類電極,金屬導線都是復蓋一層此種金屬的微溶性鹽(如:Ag/Agcl),並且插入含有此種金屬鹽陰離子的電解質溶液中。此時半電池電位或電極電位的大小取決於此種陰離子的活度。
此二種電極之間的電壓遵循能斯特(NERNST)公式:
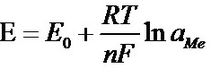 能斯特公式
能斯特公式 式中:E—電位
E0—電極的標準電壓
R—氣體常數(8.31439焦耳/摩爾和℃)
T—開氏絕對溫度(例:20℃相當於(273.15+20)293.15開爾文)
F—法拉弟常數(96493庫化/當量)
n—被測離子的化合價(銀=1,氫=1)
ln(aMe)—離子活度aMe的對數
標準氫電極是所有電位測量的參比點。標準氫電極是一根鉑絲,用電解的方法鍍(塗復)上氯化鉑,並且在四周充入氫氣(固定壓力為1013hpa)構成的。
將此電極浸入在25℃時HO離子含量為1mol/l溶液中便形成電化學中所有電位測量所參照的半電池電位或電極電位。其中氫電極作為參比電極在實踐中很難實現,於是使用第二類電極做為參比電極。其中最常用的便是銀/氯化銀電極。該電極通過溶解的AgCl對於氯離子濃度的變化起反應。
此參比電極的電極電位通過飽和的kcl貯池(如:3mol/l kcl)來實現恆定。液體或凝膠形式的電解質溶液通過隔膜與被測溶液相連通。
利用上述的電極組合—銀電極和Ag/AgCl參比電極可以測量膠片沖洗液中的銀離子含量。也可以將銀電極換成鉑或金電極進行氧化還原電位的測量。例如:某種金屬離子的氧化階段。
最常用的pH指示電極是玻璃電極。它是一支端部吹成泡狀的對於pH敏感的玻璃膜的玻璃。管內充填有含飽和AgCl的3mol/l kcl緩衝溶液,pH值為7。存在於玻璃膜二面的反映pH值的電位差用Ag/AgCl傳導系統,
如第二電極,導出。pH複合電極和pH固態電極,
此電位差遵循能斯特公式:
將E0、R、T(298.15K即25℃)等數值代入上式既得:
E=59.16mv/25℃ per pH (式中已將ln(H3O+)轉化為pH)
式中R和F為常數,n為化合價,每種離子都有其固定的值。對於氫離子來講n=1。溫度“T”做為變數,在能斯特公式中起很大作用。隨著溫度的上升,電位值將隨之增大。
對於每1℃的溫度變大,將引起電位0.2mv/per pH變化。用pH值來表示則每1℃第1pH變化0.0033pH值。
這也就是說:對於20~30℃之間和7pH左右的測量不需要對溫度變化進行補償;而對於溫度>30℃或8pH或6pH的套用場合則必須對溫度變化進行補償。
工業PH計,是一種常用的工業儀器設備,主要用來精密測量液體介質的酸鹼度值。以及安裝、清洗、抗干擾等等問題的考慮
分類
人們根據生產與生活的需要,科學地研究生產了許多型號的酸度計:
按測量精度
可分0.2級、0.1級、0.01級或更高精度。
按儀器體積
分為筆式(迷你型)、攜帶型、台式還有線上連續監控測量的線上式。
根據使用的要求
筆式(迷你型)與攜帶型pH酸鹼度計一般是檢測人員帶到現場檢測使用。
選擇pH酸鹼度計的精度級別是根據用戶測量所需的精度決定,而後根據用戶方便使用而選擇各式形狀的pH計。
◆按便攜性分的,分為:攜帶型pH計,台式pH計和筆式pH計。
◆按用途分為:實驗室用pH計,工業線上pH計等。
◆按先進程度分為經濟型pH計,智慧型型pH計,精密型pH計或分為指針式pH計,數顯式pH計。
◆筆式pH計,一般製成單一量程,測量範圍狹,為專用簡便儀器。
攜帶型和台式pH計測量範圍較廣,常用儀器,不同點是攜帶型採用直流供電,可攜帶到現場。實驗室pH計測量範圍廣、功能多、測量精度高。
工業用pH計的特點是要求穩定性好、工作可靠,有一定的測量精度、環境適應能力強、抗干擾能力強,具有模擬里量輸出、數字通訊、上下限報警和控制功能等。
級別精準度
 酸度計
酸度計 PH酸度計儀器的級別0.2級0.1級0.02級0.01級0.001級
分度值或最小顯示值(pH)0.20.10.020.010.001
電計示值誤差(pH)±0.1±0.05±0.01±0.01±0.002
配套測試示值總誤差(pH)±0.2±0.1±0.02±0.02±0.01
註:配套測試時的測試範圍應控制在pH3~pH10內。從上表可以看出,對於0.01級以下的酸度計,示值總誤差數值等於其級別,對於0.01級的酸度計,示值總誤差為0.02pH,對於0.001級酸度計,其示值總誤差也只能達到±0.01pH,而且此時需要使用一級pH標準物質才能得到保證。(注意:pH國家標準物質分一級和二級兩種,一般酸度計常用的是二級pH標準物質。)
水分測定
隨著科學研究的發展和生產技術的進步水分的定量分析已被列為各類物質理化分析的基本項目之一,作為各類物質的一項重要的質量指標。
根據不同形式試樣中的不同水分含量提出了測定水分的不同要求。水分測定可以是工業生產的控制分析,也可是工農業產品的質量簽定;可以從成噸計的產品中測定含水量等等。
測量要點
在進行操作前,應首先檢查電極的完好性。甘汞電極。由於複合電極使用比較廣泛,以下主要討論複合電極。
實驗室使用的複合電極主要有全封閉型和非封閉型兩種,全封閉型比較少,主要是以國外企業生產為主。複合電極使用前首先檢查玻璃球泡是否有裂痕、破碎,如果沒有,用pH緩衝溶液進行兩點標定時,定位與斜率按鈕均可調節到對應的pH值時,一般認為可以使用,否則可按使用說明書進行電極活化處理。活化方法是在4%氟化氫溶液中浸3~5 s左右,取出用蒸餾水進行沖洗,然後在0.1mol/L的鹽酸溶液中浸泡數小時後,用蒸餾水沖洗乾淨,再進行標定,即用pH值為6.86(25℃)的緩衝溶液進行定位,調節好後任意選擇另一種pH緩衝溶液進行斜率調節,如無法調節到,則需更換電極。非封閉型複合電極,裡面要加外參比溶液即3 mol/L氯化鉀溶液,所以必須檢查電極里的氯化鉀溶液是否在1/3以上,如果不到,需添加3 mol/L氯化鉀溶液。如果氯化鉀溶液超出小孔位置,則把多餘的氯化鉀溶液甩掉,使溶液位於小孔下面,並檢查溶液中是否有氣泡,如有氣泡要輕彈電極,把氣泡完全趕出。
在使用過程中應把電極上面的橡皮剝下,使小孔露在外面,否則在進行分析時,會產生負壓,導致氯化鉀溶液不能順利通過玻璃球泡與被測溶液進行離子交換,會使測量數據不準確。測量完成後應把橡皮復原,封住小孔。電極經蒸餾水清洗後,應浸泡在3 mol/L氯化鉀溶液中,以保持電極球泡的濕潤,如果電極使用前發現保護液已流失,則應在3 mol/L氯化鉀溶液中浸泡數小時,以使電極達到最好的測量狀態。在實際使用時,發現有的分析人員把複合電極當作玻璃電極來處理,放在蒸餾水中長時間浸泡,這是不正確的,這會使複合電極內的氯化鉀溶液濃度大大降低,導致在測量時電極反應不靈敏,最終導致測量數據不準確,因此不應把複合電極長時間浸泡在蒸餾水中。
電極使用
1、玻璃電極插座應保持乾燥、清潔,嚴禁接觸酸霧、鹽霧等有害氣體,嚴禁沾上水溶液,保證儀器的高輸入阻抗。
2、 不進行測量時,應將輸入短路,以免損壞儀器。
3、 新電極或久置不用的電極在使用前,必須在蒸餾水中浸泡數小時。使電極不對稱電位降低達到穩定,降低電極內阻。
4、 測量時,電極球泡應全部浸入被測溶液中。
5、 使用時,應使內參比電極浸在內參比溶液中,不要讓內參比溶液倒向電極帽一端,使內參比懸空。
6、 使用時,應拔去參比電極電解液加液口的橡皮塞,以使參比電解液(鹽橋)借重力作用維持一定流速滲透並與被測溶液相通。否則,會造成讀數漂移。
7、 氯化鉀溶液中應該沒有氣泡,以免使測量迴路斷開。
8、 應該經常添加氯化鉀鹽橋溶液,保持液面高於銀/氯化銀絲。
校準溶液
pH測量一定要標定校準嗎?
pH測量通常有比色法(pH試紙或比色皿)和電極法二種。比色法當然不要標定,而電極法就一定要標定,因為電極法pH測量就是將未知溶液與已知pHs值的標準溶液在測量電池中作用比較測定,這是電極法pH測量的“操作定義”所決定的。
pH計因電計設計的不同而類型很多,其操作步驟各有不同,因而pH計的操作應嚴格按照其使用說明書正確進行。在具體操作中,校準是pH計使用操作中的一重要步驟。表1的數據是精度為0.01級、經過計量檢定合格的pH計在未校準時與校準後的測量值,從中可以看出校準的重要性。
儘管pH計種類很多,但其校準方法均採用兩點校準法,即選擇兩種標準緩衝液:一種是pH7標準緩衝液,第二種是pH9標準緩衝液或pH4標準緩衝液。先用pH7標準緩衝液對電計進行定位,再根據待測溶液的酸鹼性選擇第二種標準緩衝液。如果待測溶液呈酸性,則選用pH4標準緩衝液;如果待測溶液呈鹼性,則選用pH9標準緩衝液。若是手動調節的pH計,應在兩種標準緩衝液之間反覆操作幾次,直至不需再調節其零點和定位(斜率)鏇鈕,pH計即可準確顯示兩種標準緩衝液pH值。則校準過程結束。此後,在測量過程中零點和定位鏇鈕就不應再動。若是智慧型式pH計,則不需反覆調節,因為其內部已貯存幾種標準緩衝液的pH值可供選擇、而且可以自動識別並自動校準。但要注意標準緩衝液選擇及其配製的準確性。智慧型式0.01級pH計一般記憶體有三至五種標準緩衝液pH值,如科立龍公司的KL-016型pH計等。
其次,在校準前應特別注意待測溶液的溫度。以便正確選擇標準緩衝液,並調節電計面板上的溫度補償鏇鈕,使其與待測溶液的溫度一致。不同的溫度下,標準緩衝溶液的pH值是不一樣的。
校準工作結束後,對使用頻繁的pH計一般在48小時內儀器不需再次定標。如遇到下列情況之一,儀器則需要重新標定:
⑴溶液溫度與定標溫度有較大的差異時.
⑵電極在空氣中暴露過久,如半小時以上時.
⑶定位或斜率調節器被誤動;
⑷測量過酸(pH12)的溶液後;
⑸換過電極後;
⑹當所測溶液的pH值不在兩點定標時所選溶液的中間,且距7pH又較遠時。
1、 測量時應按說明書規定的時間周期對儀器進行校準。
2、 校準時應注意:
標準緩衝溶液溫度儘量與被測溶液溫度接近。
定位標準緩衝溶液應儘量接近被測溶液的pH值。或兩點標定時,應儘量使被測溶液的pH值在兩個標準緩衝溶液的區間內。
校準後,應將浸入標準緩衝溶液的電極用水特別沖洗,因為緩衝溶液的緩衝作用,帶入被測溶液後,造成測量誤差。
3、 記錄被測溶液的pH值時應同時記錄被測溶液的溫度值,因為離開溫度值,pH值幾乎毫無意義。儘管大多數pH計都具有溫度補償功能,但僅僅是補償電極的回響而已,也就是說只是半補償,而沒有同時對被測溶液進行溫度補償,即,全補償。
避免反應
如何避免被測溶液與鹽橋成分反應?
如果被測溶液含有可溶性銀鹽、一價汞鹽或鉈鹽時,鹽橋內不能利用氯化鉀溶液,而應該用飽和硝酸鉀或硝酸銨溶液方能獲得滿意的測量結果。對非水溶液則套用碘化鈉的甲醇溶液和硫氰化鉀的乙醇溶液為中間溶液。
總之,不能使鹽橋溶液中的成分與被測溶液發生沉澱、氧化還原反應等現象,不然會干擾電動勢測定。
如雙液接參比電極在測Cl濃度中的套用。
關於pH計的常見信號顯示儀表 ProtEX RT6820......模擬信號輸入型/積算型顯示儀表輸入信號 4~20mA, Loop-Power迴路供電電壓降幅 2.8V, (帶背光時5.8V)支持線性的、平方根的或可程式的數學運算Loop-Power迴路供電 或 DC供電背光可選 ProtEX RT6830.....脈衝信號輸入型/積算型顯示儀表電池供電, DC供電, 或輸出迴路供電電池供電, DC供電, 或輸出迴路供電 背光可選 ProtEX_Lite PD663 防爆型迴路供電過程顯示儀表輸入信號 4~20mA電壓降幅 1.7V, (帶背光時4.9V)3-1/2+LCDS數字,0.6”高迴路供電背光可選快捷的四鍵編程問題
pH計的用途
pH計廣泛用於淨水、自來水、生活用水及各種液體的酸鹼度測試。pH值在7.0為中性,7.0以下為酸性,7.0以上為鹼性。
保養維護
保養
1、 pH玻璃電極的貯存
短期:貯存在pH=4的緩衝溶液中;
長期:貯存在pH=7的緩衝溶液中。
2、 pH玻璃電極的清洗
玻璃電極球泡受污染可能使電極回響時間加長。可用CCl或皂液揩去污物,然後浸入蒸餾水一晝夜後繼續使用。污染嚴重時,可用5%HF溶液浸10~20分鐘,立即用水沖洗乾淨,然後浸入0.1N HCl溶液一晝夜後繼續使用。
3、 玻璃電極老化的處理
玻璃電極的老化與膠層結構漸進變化有關。舊電極回響遲緩,膜電阻高,斜率低。用氫氟酸浸蝕掉外層膠層,經常能改善電極性能。若能用此法定期清除內外層膠層,則電極的壽命幾乎是無限的。
4、 參比電極的貯存
銀-氯化銀電極最好的貯存液是飽和氯化鉀溶液,高濃度氯化鉀溶液可以防止氯化銀在液接界處沉澱,並維持液接界處於工作狀態。此方法也適用於複合電極的貯存。
5、 參比電極的再生
參比電極發生的問題絕大多數是由液接界堵塞引起的,可用下列方法解決:
(1) 浸泡液接界:用10%飽和氯化鉀溶液和90%蒸餾水的混合液,加熱至60~70℃,將電極浸入約5cm,浸泡20分鐘至1小時。此法可溶去電極端部的結晶。
(2) 氨浸泡:當液接界被氯化銀堵塞時可用濃氨水浸除。具體方法是將電極內充洗淨,液放空後浸入氨水中10~20分鐘,但不要讓氨水進入電極內部。取出電極用蒸餾水洗淨,重新加入內充液後繼續使用。
(3) 真空方法:將軟管套住參比電極液接界,使用水流吸氣泵,抽吸部分內充液穿過液接界,除去機械堵塞物。
(4) 煮沸液接界:銀-氯化銀參比電極的液接界浸入沸水中10~20秒。注意,下一次煮沸前,應將電極冷卻到室溫。
(5) 當以上方法均無效時,可採用砂紙研磨的機械方法去除堵塞。此法可能會使研磨下的砂粒塞入液接界。造成永久性堵塞。
維護
實驗室使用的電極都是複合電極,其優點是使用方便,不受氧化性或還原性物質的影響,且平衡速度較快。使用時,將電極加液口上所套的橡膠套和下端的橡皮套全取下,以保持電極內氯化鉀溶液的液壓差。下面就把電極的使用與維護簡單作一介紹:
⒈複合電極不用時,可充分浸泡3M氯化鉀溶液中。切忌用洗滌液或其他吸水性試劑浸洗。
⒉使用前,檢查玻璃電極前端的球泡。正常情況下,電極應該透明而無裂紋;球泡內要充滿溶液,不能有氣泡存在。
⒊測量濃度較大的溶液時,儘量縮短測量時間,用後仔細清洗,防止被測液粘附在電極上而污染電極。
⒋清洗電極後,不要用濾紙擦拭玻璃膜,而套用濾紙吸乾, 避免損壞玻璃薄膜、防止交叉污染,影響測量精度。
⒌測量中注意電極的銀—氯化銀內參比電極應浸入到球泡內氯化物緩衝溶液中,避免電計顯示部分出現數字亂跳現象。使用時,注意將電極輕輕甩幾下。
⒍電極不能用於強酸、強鹼或其他腐蝕性溶液。
⒎嚴禁在脫水性介質如無水乙醇、重鉻酸鉀等中使用。
1、 pH玻璃電極的貯存
短期:貯存在pH=4的緩衝溶液中;
長期:貯存在pH=7的緩衝溶液中。
2、 pH玻璃電極的清洗
安裝維護
 酸度計
酸度計 污水處理廠一般選用的是浸入式安裝,如該污水處理廠的pH計安裝在沉砂池的出口溢流槽內,此處的pH值較具有代表性,且水流平穩,對pH計不會造成大的衝擊。定期的維護有助於儀表的準確測量和延長儀表的使用壽命。應當注意感測器和變送器之間的專用電纜不能受潮,否則電極的高阻低壓信號將無法傳送至變送器。
若電極不測量時,應將黃色保護套管套上,它能使電極處於濕潤狀態,有利於延長電極的使用壽命。每隔一個月左右,應對電極進行清洗,先用柔和的水流噴洗附著物,再將電極浸泡於清洗液中一段時間,而後用清水洗淨。
感測器支架也應清洗。每次清洗之後,要用緩衝劑溶液進行標定,國產的pH標定液中,pH=4的還可以,pH=7的不夠準確,將會影響標定結果。所以最好使用生產廠家的標定液,生產廠家一般提供兩瓶標準溶液,一瓶pH值等於7,用於標定儀表零點;一瓶pH值等於4,用於標定儀表的信號輸出斜率。
選購要點
如何選購pH計|酸度儀|酸度計?應注意五大點。
我們在選購酸度儀時,首先要考慮套用場合,選擇筆式pH計,攜帶型酸度儀,台式酸度計或是工業用pH計;其次是考慮測量需要的精度,選擇合適自己使用的精度. BpH-200A型pH計廣泛套用於工業、電力、農業、醫藥、食品、科研和環保等領域。該儀器也是食品廠、飲用水廠辦QS、HACCP認證中的必備檢驗設備。
我們在選購酸度計時需要考慮以下幾點:
1.根據套用場合分類可分為:筆式pH計、攜帶型pH計、實驗室pH計和工業pH計等。筆式pH計主要用於代替pH試紙的功能,具有精度低、使用方便的特點。
攜帶型pH計主要用於現場和野外測方式,要求較高的精度和完善的功能。
實驗室pH計是一種台式高精度分析儀表,要求精度高、功能全,包括列印輸出、數據處理等等。
工業pH計是用於工業流程的連續測量,不僅要有測量顯示功能,還要有報警和控制功能,以及安 裝、清洗、抗干擾等等問題的考慮。
2.據pH計儀器精度分類:可分為0.2級、0.1級、0.05級、0.01級,數字越小,精度越高。
3.根據元器件類型分類:可分為電晶體式、積體電路式和單片機微電腦式,更多的是套用微電腦晶片,大大減少了儀器體積和單機成本;但晶片的開發成本很貴
4根據讀數指示分類:可分為指針式和數字顯示式二種。指針式pH計已很少使用,但指針式儀表能夠顯示數據的連續變化過程,因此在滴定分析中還有使用。
5.看pH計有沒有附帶功能,比方說帶標配RS232接口,還有一個很重的是溫度補償是自動
還是手動,自動溫度補償的pH計要比手動溫度補償的pH計要方便些,二者之間的價格你就明白了吧。
備註:pH計|酸度儀|酸度計這三個名稱意思都一樣,只是各地方或者廠家說法不一樣
相關術語
pH值
1. 什麼是水的pH值?它有什麼意義?
pH值是水溶液最重要的理化參數之一。凡涉及水溶液的自然現象,化學變化以及生產過程都與pH值有關,因此,在工業、農業、醫學、環保和科研領域都需要測量pH值。
水的pH值是表示水中氫離子活度的負對數值,表示為:
pH= - lg aH
pH值有時也稱氫離子指數,由於氫離子活度的數值勤往往很小,在套用很不方便,所以就用pH值之一概念來作為水溶液酸性、鹼性的判斷指示。而且,氫離子活度的負對數值能夠表示出酸性、鹼性的變化幅度的數量級的大小,這樣套用起來就十分方便,並由此得到:
⑴中性水溶液,pH= - lg aH=-lg10=7
⑵酸性水溶液,pH7,pH值越大,表示鹼性越強。
pH標度
pH測量是一種相對測量,它僅僅指示標準溶液與未知溶液之間的pH差別,實際測量時,需要用標準緩衝溶液定期進行校準。因此,為了達到量值的一致,必須建立pH標度。pH標度範圍定為0~14pH,pH標度的量值由基準緩衝溶液的pHs值確定。
因此,pH標度的含義可表達為:根據pH定義,在0~14pH範圍內選擇若干個pH緩衝溶液作為pH標度的固定點,並且採用當代技術能達到的最準確的方法測定它們的pHs值。國際上有二種pH標度,即多種基準pH標度和單種基準pH標度,中國採用多種基準pHs標度。
pH緩衝溶液
pH緩衝溶液是一種能使pH值保持穩定的溶液。如果向這種溶液中加入少量的酸或鹼,或者在溶液中的化學反應產生少量的酸或鹼,以及將溶液適當稀釋,這個溶液的pH值基本上穩定不變,這種能對抗少量酸或鹼或稀釋,而使pH值不易發生變化的溶液就稱為pH緩衝溶液。
pH標準緩衝溶液具有以下特點:
⑴標準溶液的pH值是已知的,並達到規定的準確度。
⑵標準溶液的pH值有良好的復現性和穩定性,具有較大的緩衝容量,較小的稀釋值和較小的溫度係數。
⑶溶液的製備方法簡單。
如何配製pH緩衝溶液?
對於一般的pH測量,可使用成套的pH緩衝試劑(可配製250ml),配製溶液時,應使用去離子水,並預先煮沸15~30分鐘,以除去溶解的二氧化碳。剪開塑膠袋將試劑倒入燒杯中,用適量去離子水使之溶解,並沖洗包裝袋,再倒入250ml容量瓶中,稀釋至刻度,充分搖勻即可。
如何正確保存和使用pH緩衝溶液?
緩衝溶液配製後,應裝在玻璃瓶或聚乙稀瓶中(鹼性的pH緩衝液如pH9.18、pH10.01、pH12.46等,應裝在聚乙稀瓶中)瓶蓋嚴密蓋緊,在冰櫃中低溫(5-10℃)保存,一般可使用二個月左右,如發現有混濁、發霉或沉澱等現象,不能繼續使用。使用時,應準備幾個50ml的聚乙稀小瓶,將大瓶中緩衝溶液倒入小瓶中,並在環境溫度下放置1~2小時,等溫度平衡後再使用。使用後不得再倒回大瓶中,以免污染,小瓶中的緩衝溶液在>10℃的環境條件下可以使用2~3天,一般pH7.00、pH6.86及pH4.00三種溶液使用時間可以長一些,pH9.18和pH10.01溶液由於吸收空氣中的CO,其pH值比較容易變化.
pH緩衝溶液有何用途?
⑴pH測量前標定校準pH計。
⑵用以檢定pH計的準確性,例如用pH6.86和pH4.00標定pH計後,將pH電極插入pH9.18溶液中,檢查儀器顯示值和標準溶液的pHs值是否一致。
⑶在一般精度測量時檢查pH計是否需要重新設定。pH計標定並使用後也許會產生漂移或變化,因此在測試前將電極插入與被測溶液比較接近的標準緩衝液中,根據誤差大小確定是否需要重新標定。
⑷檢測pH電極的性能。
8. 使用瓶裝的pH緩衝溶液有什麼優點?
在pH計經銷商處一般還有用聚乙稀塑膠瓶瓶裝的pH標準緩衝溶液銷售。它和用pH緩衝試劑自己配製的緩衝溶液比較,由於它其中添加了顯色劑和防腐劑,因此不同pH值的緩衝液有不同的顏色,使用時不易搞錯,並且在常溫下保存不會發霉變質,保存期可長達一年,因此使用特別方便。有pH4.00、pH6.86、pH7.00、pH9.18、pH10.01五種,並有500ml大瓶和50ml小瓶二種規格。
pH電極
實驗室和工業型pH電極有什麼區別?從使用上講,實驗室pH電極是在較好的環境條件下進行短時間間斷測試;而工業pH電極是在較差的環境條件下進行長期連續的測試。從性能上講,實驗室pH電極要求電極的準確性和重複性要好,回響快;而工業pH電極則要求電極的長期穩定性好。從結構上講實驗室pH電極要求簡單輕便,而工業型pH電極則要求結構牢固,要考慮能夠安裝,並且能抵抗各種電場和磁場的干擾。
pH電極為何要浸泡?如何正確浸泡?pH電極使用前必須浸泡,因為pH球泡是一種特殊的玻璃膜,在玻璃膜表面有一很薄的水合凝膠層,它只有充分濕潤的條件下才能與溶液中的H+離子良好的回響。同時,玻璃電極經過浸泡,可以使不對稱電勢大大下降並趨向穩定。
pH玻璃電極一般可以用蒸餾水或pH4緩衝溶液浸泡。通常使用pH4緩衝液更好一些,浸泡時間8小時至24小時或更長,根據球泡玻璃膜厚度、電極老化程度而不同。同時,參比電極的液接界也需要浸泡。因為如果液接界乾涸會使液接界電勢增大或不穩定,參比電極的浸泡液必須和參比電極的外參比溶液一致,即3.3mol/LKCl溶液或飽和KCl溶液,浸泡時間一般幾小時即可。
因此,對pH複合電極而言,就必須浸泡在含KCl的pH4緩衝液中,這樣才能對玻璃球泡和
液接界同時起作用。這裡要特別提醒注意,因為過去人使用單支的pH玻璃電極已習慣於用去離子水或pH4緩衝液浸泡,後來使用pH複合電極時依然採用這樣的浸泡方法引起的直接後果就是使一支性能良好的pH複合電極變成一支回響慢、精度差的電極,而且浸泡時間越長性能越差,因為經過長時間的浸泡,液接界內部(例如砂芯內部)的KCl濃度已大大降低了,使液接界電勢增大和不穩定。當然,只要在正確的浸泡溶液中重新浸泡數小時,電極還是會復原的。
另外,pH電極也不能浸泡在中性或鹼性的緩衝溶液中,長期浸泡在此類溶液中會使pH玻璃膜回響遲鈍。正確的pH電極浸泡液的配製:取pH4.00緩衝劑(250ml)一包,溶於250ml純水中,再加入56克分析純KCl,適當加熱,攪拌至完全溶解即成。pH電極如何清洗?球泡和液接界污染後先用以下溶劑清洗,再用去離子水洗去溶劑,將電極浸入浸泡液中活化。
污 染 物 清 洗 劑
無機金屬氧化物 低於1mol/L稀酸
有機油脂類物 稀洗滌劑(弱酸性)
樹脂高分子物質 稀酒精、丙酮、乙醚
蛋白質血球沉澱物 酸性酶溶液(如食母生片)
顏料類物質 稀漂白液、過氧化氫
如何檢測pH電極的好壞?用戶可按下表數據自行檢測pH電極的好壞,步驟如下(pH計調至mV檔)
⑴測試零電位pH值,零點pH值:7±0.5pH pH電極插入pH4.00緩衝液中,穩定後讀數(預先測試出溶液的溫度)。例如25℃時讀數值E1’=186mV(取絕對值),而準確值為178mV(見表格),則誤差值=186-178mV,換算成pH值:8/59.16=0.14pH(59.16mV/pH是25℃時的K值,見表格)。因此零點pH值合格。一般新電極零電位誤差≤±0.3pH,如零電位誤差>±0.5pH,電極的測試誤差會比較大,尤其當測試溶液溫度變化較大時誤差會更大。如果測試精度要求不高,則零電位誤差值還可以大一些,但最大不能超過1pH.
⑵測試電極百分理論余率(PTS)
記錄(1)步驟中的測試數據186mV,將電極清洗後再插入pH9.18緩衝液中,穩定後讀數,E2’=111mV(取絕對值),ΔE’=E1’+E2’=186+111=297mV,與表格中的ΔE對照,PTS=97%,合格,一般新電極PTS≥97%,使用長久的電極可以放寬一些,但一般應PTS≥95%,除非測試精度要求很低。
⑶將電極清洗後再插入pH4.00緩衝液,將讀數與步驟(1)的數據比較,其誤差應≤±2mV,否則表示電極重複性較差。
⑷電極的測試讀數應該在30-60秒內穩定,否則表示電極回響太慢。
pH指示電極
對溶液中氫離子活度有回響,電極電位隨之而變化的電極稱為pH指示電極或pH測量電極。pH指示電極有氫電極、銻電極和玻璃電極等幾種,但最常用的是玻璃電極。玻璃電極是由玻璃支桿,以及由特殊成份組成的對氫離子敏感的玻璃膜組成。玻璃膜一般呈球泡狀,球泡內充入內參比溶液,插入內參比電極(一般用銀/氯化銀電極),用電極帽封接引出電線,裝上插口,就成為一支pH指示電極。市場銷售的最常用的pH指示電極是231玻璃pH電極。單獨一支pH指示電極是無法進行測量的,它必須和參比電極一起才能測量。
pH複合電極
將pH玻璃電極和參比電極組合在一起的電極就稱為pH複合電極。外殼為塑膠的就稱為塑殼pH複合電極。外殼為玻璃的就稱為玻璃pH複合電極。複合電極的最大優點是合二為一,使用方便。pH複合電極的結構主要由電極球泡、玻璃支持桿、內參比電極、內參比溶液、外殼、外參比電極、外參比溶液、液接界、電極帽、電極導線、插口等組成。
⑴電極球泡:它是由具有氫功能的鋰玻璃熔融吹制而成,呈球形,膜厚在0.1~0.2mm左右,電阻值

