正文
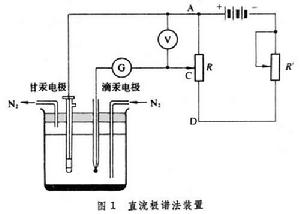
它與其他控制電位的極譜法和伏安法的區別在於電極電位改變的速率很慢。雖然加在滴汞電極和參比電極上的電壓是變化的,但變化的速率很慢,對每一個滴汞電極的汞滴來說,在汞滴存在期間,汞滴的電位是恆定的,電流只隨汞滴面積的改變而變化,因而稱為恆電位極譜法,利用這種方法要通過很多汞滴才能得到一條電流-電位曲線。裝置 主要有三部分(圖1):
 ①加電壓裝置:它提供加在電解池兩個電極的直流電壓,包括直流電源(3~4伏)、分壓電阻 R等。通過調節分壓電阻改變加到電解池兩個電極上的電壓,其數值由伏特計指示。②測量電流的裝置包括檢流計和分流器。由於極譜電流很小,以微安為單位,要用比較靈敏的檢流計。③電解池有兩個電極:一個是面積很小的、表面不斷更新的滴汞電極,叫指示電極;另一個是面積比較大的電位保持恆定的電極,叫參比電極,通常是甘汞電極或鍍汞銀電極。極譜電解池不用攪拌溶液的裝置,需要經常通入氮氣或氫氣,以除去溶液中的氧。
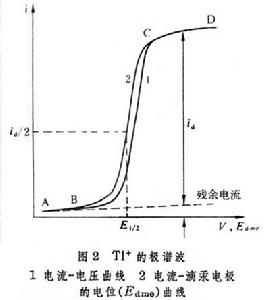
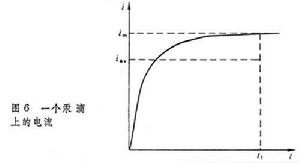
①加電壓裝置:它提供加在電解池兩個電極的直流電壓,包括直流電源(3~4伏)、分壓電阻 R等。通過調節分壓電阻改變加到電解池兩個電極上的電壓,其數值由伏特計指示。②測量電流的裝置包括檢流計和分流器。由於極譜電流很小,以微安為單位,要用比較靈敏的檢流計。③電解池有兩個電極:一個是面積很小的、表面不斷更新的滴汞電極,叫指示電極;另一個是面積比較大的電位保持恆定的電極,叫參比電極,通常是甘汞電極或鍍汞銀電極。極譜電解池不用攪拌溶液的裝置,需要經常通入氮氣或氫氣,以除去溶液中的氧。 極譜測定過程 以測定Tl+的濃度為例,被測物是硝酸鉈TlNO3水溶液,濃度約10-3Μ。測定前先在溶液中加入比TlNO3濃度大50~100倍的另一種無機鹽(如氯化鉀),稱為支持電解質,它的作用是解脫電解過程中Tl+在溶液中承擔的傳導電流的作用。還要在溶液中加入一滴酸性品紅溶液或其他極化抑制劑,以消除測定過程中可能出現的異常極譜電流(極大現象)。通氮氣除氧後,逐步增大外加電壓,每改動一次電壓,讀一次電流的數值,然後繪製電流-電壓曲線(圖2,曲線1):
 直流極譜法
直流極譜法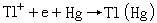
2HG+2Cl-─→Hg2Cl2+2e
電解開始後,隨著電壓的增大,電流急劇上升,形成電流-電壓曲線上的BC部分。此後,電流達到一個極限值(CD部分),稱為極限電流,它與殘餘電流之差稱為極限擴散電流,又稱波高,以id表示。波高與溶液中Tl+的濃度成正比,是極譜定量分析的基礎。以上記錄極譜波的方法是手工式的,現有的極譜儀都能自動記錄極譜波。特點 ①極譜法使用兩個電極:極化電極和去極化電極。它使用滴汞電極為指示電極,它的電位隨外加電壓的變化而變,稱為極化電極。參比電極面積很大,電位保持恆定,不隨外加電壓的變化而變,稱為去極化電極。
如果通過電解池的電流為i,線路中的總電阻為R,外加電壓為V,滴汞電極的電位為Edme,參比電極的電位為ES,則可得:
V=(ES-Edme)-iR
Edme-ES=-(V+iR)
由於參比電極的電位不變,以參比電極的電位為標準的滴汞電極的電位完全隨外加電壓的變化而變,就可以通過控制滴汞電極的電位,使標準電極電位值有差異的金屬離子在不同的電位析出(圖3)。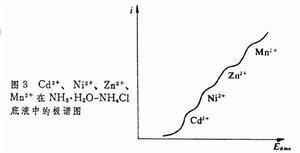 直流極譜法
直流極譜法極譜波方程式 Tl+在滴汞電極上的還原反應為可逆反應。根據能斯脫公式可有:
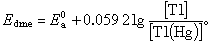
 直流極譜法
直流極譜法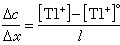
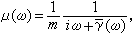
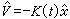
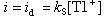
 直流極譜法
直流極譜法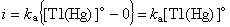
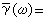
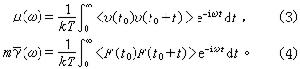
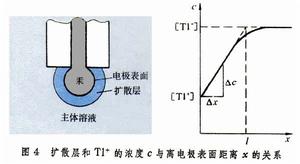
伊爾科維奇方程式 該式為:
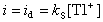
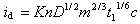
 直流極譜法
直流極譜法②標準加入法 先取Μ毫升試樣溶液,測量其波高h,然後加入N毫升被測離子的標準溶液(濃度為cs),再測一次波高,其值為H,按下式求試樣濃度cX:
直流極譜法是一種廣泛套用的快速分析方法,適用於測定能在電極上還原或氧化的物質,包括有機物和無機物,測Cu、Cd、Zn、Ni、Pb、Na、Fe、K、Eu、Sn、In、Tl時,濃度範圍為10-2~10-5M,誤差一般為±1%。使用精密的儀器時,誤差為±0.5%。