簡介
利用測量電導或電導的變化進行分析的電化學分析法。
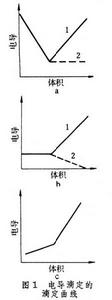
電導滴定法 測量滴定過程中電導G的變化,然後根據滴定曲線(有時以直線形式出現)求出滴定終點,從而算出欲測物質的量。電導滴定法可分中和滴定、沉澱滴定、絡合滴定和氧化還原滴定。圖1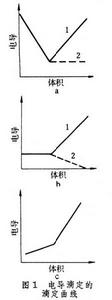 為滴定曲線,分三種類型。
為滴定曲線,分三種類型。 圖1a是中和滴定的滴定曲線(見酸鹼滴定法),其中曲線1是強鹼滴定弱酸的滴定曲線,滴定終點很明顯,因為在反應中生成水,所以電導不斷降低,直到終點時不再下降,過量的鹼又使電導很快地上升;曲線2是弱鹼滴定強酸,過了終點以後,由於弱鹼的電離度很小,雖然加入過量的弱鹼,電導幾乎不變。
圖1b中的曲線 1是沉澱滴定的滴定曲線(見沉澱滴定法),例如在AgNO3+NaCl─→AgCl+NaNO3反應中,Na+代替Ag+,生成氯化銀沉澱,所以滴定開始時電導變化不大,過了終點以後,繼續加入氯化鈉,電導上升;曲線2 是絡合滴定的滴定曲線(見絡合滴定法),例如在酸性溶液中進行以下反應;Hg(NO3)2+2KCN─→Hg(CN)2+2KNO3,兩個K+代替Hg2+,生成Hg(CN)2,滴定開始時,電導變化不大,過了終點以後,繼續加入KCN,發生H++CN-+K+─→HCN+K+反應,由於HCN的電離度很小,因此電導下降。
圖1c是強鹼滴定極弱的酸的滴定曲線,電導逐漸增大,過了終點以後,因加入強鹼而使電導上升,終點在兩直線的轉折點。
實際上,在終點附近的滴定曲線往往呈圓弧形或終點很不明顯。這一現象與酸鹼的強弱、沉澱的溶解度、絡合物的穩定性和欲測物質的濃度有關,太稀的溶液(濃度在 10-3Μ以下)不容易得到準確的滴定結果。電導滴定法也可用於非水介質中。
電導測量法 測量電導的電導池有不同的設計方案,一般由兩個鉑黑電極(面積為1厘米2)組成。測量電導實際上是測量電阻,圖2
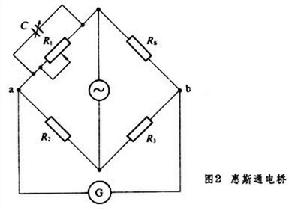 是最常用的惠斯通電橋法的線路圖。Rs是欲測的電阻(即欲測的電導),R1大致等於Rs,C為可變電容。調節R2和R3,使電橋兩端a和b的電位差等於零,由“指零”(G)來指示,它是一個耳機或交流檢流計,當電橋平衡時:
是最常用的惠斯通電橋法的線路圖。Rs是欲測的電阻(即欲測的電導),R1大致等於Rs,C為可變電容。調節R2和R3,使電橋兩端a和b的電位差等於零,由“指零”(G)來指示,它是一個耳機或交流檢流計,當電橋平衡時: 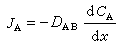
根據以上原理設計的各種電導儀可用於測定弱酸的離解常數、沉澱的溶度積以及檢測水的純度。實驗室中高純的電導水的電導率小於 0.1×10-6西(門子)/厘米,蒸餾水與空氣中的二氧化碳達到平衡時平衡水的電導率約為 1×10-6西/厘米,一般電導滴定的溶液的電導率大於1×10-3西/厘米,所以水的電導率可以忽略不計。