簡介
滴定最基本的公式為:
c1 V1 / ν1 = c2 V2 / ν2
其中c為溶液濃度,V為溶液體積,ν為反應方程式中的係數。
原理
 滴定
滴定滴定過程需要一個定量進行的反應,此反應必須能完全進行,且速率要快,也就是平衡常數、速率常數都要
較大。而且反應還不能有干擾測量的副產物,副反應更是不允許的。
在兩種溶液的滴定中,已知濃度的溶液裝在滴定管里,未知濃度的溶液裝在下方的錐形瓶里。通常把已知濃度的溶液叫做標準溶液,它的濃度是與不易變質的固體基準試劑滴定而測得的。
反應停止時,讀出用去滴定管中溶液的體積,即可用公式算出濃度。
根據反應類型的不同,滴定分為以下種類:
酸鹼中和滴定(利用中和反應) (指示劑常用甲基橙、酚酞)
氧化還原滴定(利用氧化還原反應)
沉澱滴定(利用生成沉澱的反應)
絡合滴定(利用絡合反應)
指示劑
滴定反應需要靈敏的指示劑來指示反應的完成。指示劑在反應完成時,會迅速變成另一種顏色。這樣實驗者就可以根據指示劑的變色來確定反應的終止。
中和滴定的指示劑是有機弱酸或弱鹼,它們的變色範圍在等電點附近。如弱酸的變色(以HIn代表):
HIn (酸色形) = H+ + In-(鹼色形)
指示劑一般有兩種形態,兩種形態呈現不同的顏色。指示劑在變色範圍內呈現過渡色。有的指示劑有三種不同顏色的形態。
由於在變色範圍時會發生“突躍”現象,顏色會變得很迅速,只要1滴溶液就可以讓指示劑完全變色,因此選擇指示劑時,只需讓反應完成時的pH值落在突躍範圍內即可,不必苛求準確。
其他種類滴定的指示劑一般是與某種反應物有靈敏反應的物質。當反應物消耗完畢時,指示劑就會變色。甚至有些反應物也可以作為指示劑,如高錳酸鉀
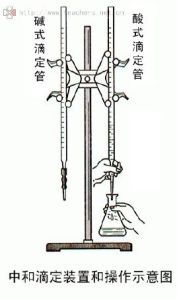
操作步驟
進行滴定時,應將滴定管垂直地夾在滴定管架上。
如使用的是酸管,左手無名指和小手指向手心彎曲,輕輕地貼著出口管,用其餘三指控制活塞的轉動。但應注意不要向外拉活塞以免推出活塞造成漏水;也不要過分往裡扣,以免造成活塞轉動困難,不能操作自如。
如使用的是鹼管,左手無名指及小手指夾住出口管,拇指與食指在玻璃珠所在部位往一旁(左右均可)捏乳膠管,使溶液從玻璃珠旁空隙處流出。注意:①不要用力捏玻璃珠,也不能使玻璃珠上下移動;②不要捏到玻璃珠下部的乳膠管;③停止滴定時,應先鬆開拇指和食指,最後再鬆開無名指和小指。
無論使用哪種滴定管,都必須掌握下面三種加液方法:①逐滴連續滴加;②只加一滴;③使液滴懸而未落,即加半滴。
滴定操作中應注意以下幾點:
⑴ 搖瓶時,應使溶液向同一方向作圓周運動(左右鏇轉均可),但勿使瓶口接觸滴定管,溶液也不得濺出。
⑵ 滴定時,左手不能離開活塞任其自流。
⑶ 注意觀察溶液落點周圍溶液顏色的變化。
⑷ 開始時,應邊搖邊滴,滴定速度可稍快,但不能流成“水線”。接近終點時,應改為加一滴,搖幾下。最後,每加半滴溶液就搖動錐形瓶,直至溶液出現明顯的顏色變化。加半滴溶液的方法如下:微微轉動活塞,使溶液懸掛在出口管嘴上,形成半滴,用錐形瓶內壁將其沾落,再用洗瓶以少量蒸餾水吹洗瓶壁。用鹼管滴加半滴溶液時,應先鬆開拇指和食指,將懸掛的半滴溶液沾在錐形瓶內壁上,再放開無名指與小指。這樣可以避免出口管尖出現氣泡,使讀數造成誤差。
⑸ 每次滴定最好都從0.00開始(或從零附近的某一固定刻度線開始),這樣可以減小誤差。
(6)滴定結束後,滴定管內剩餘的溶液應棄去,不得將其倒回原瓶,以免沾污整瓶操作溶液。隨即洗淨滴定管,並用蒸餾水充滿全管,備用。
讀數
裝滿或放出溶液後,必須等1~2分鐘,使附著在內壁的溶液流下來,再進行讀數。如果放出溶液的速度較慢(例如,滴定到最後階段,每次只加半滴溶液時),等0.5~1分鐘即可讀數。每次讀數前要檢查一下管壁是否掛水珠,管尖是否有氣泡。
必須讀到小數點後第二位,即要求估計到0.01mL。注意,估計讀數時,應該考慮到刻度線本身的寬度。
讀取初讀數前,應將管尖懸掛著的溶液除去。滴定至終點時應立即關閉活塞,並注意不要使滴定管中的溶液有稍許流出,否則終讀數便包括流出的半滴液。因此,在讀取終讀數前,應注意檢查出口管尖是否懸掛溶液,如有,則此次讀數不能取用。