基本信息
從理論上講,滴定應在到達等當點時結束,但實際上很難正好滴定到這一點,因此滴定誤差總是存在的。滴定誤差是容量分析誤差的重要來源,是採用任何滴定方法時首先要考慮的問題。除滴定誤差外,試樣的稱重、溶液體積的測量、指示劑的消耗等也會影響容量分析的準確度,並帶來一定的誤差。由於溶液體積測量的誤差為0.1%~0.2%,而試樣的稱重,指示劑的消耗兩項所帶來的誤差都比較小,所以滴定誤差只要控制在這一數值以下就可以了。
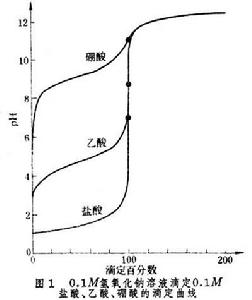
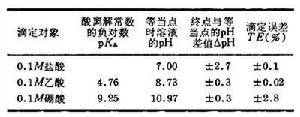
對一定的體系來說,終點離等當點愈近,滴定誤差就愈小,因此應當根據等當點的情況來選擇合適的指示劑。但是對不同的體系,等當點附近的突躍大小是不同的。終點離等當點近,滴定誤差未必小;終點離等當點遠,滴定誤差也未必大。以酸鹼滴定為例,如果以0.1Μ氫氧化鈉溶液滴定不同強度的一元酸,所產生的滴定誤差足以說明以上論述(見表)。由滴定曲線條目中圖1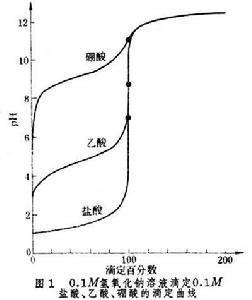 所示的曲線可以看出,氫氧化鈉滴定鹽酸時,等當點附近突躍大,表明加入少量氫氧化鈉引起較大的pH變化。因此,即使終點離等當點遠些(ΔpH為2.7pH單位),所引起的滴定誤差仍很小,只有 0.1%。在滴定硼酸時,等當點附近pH變化緩慢,說明要改變較大的pH需要加入較多的滴定劑,這時即使能找到在等當點變色的指示劑,但由於人眼判斷終點會產生0.3pH單位的誤差,即終點與等當點相差 ±0.3pH單位,所造成的滴定誤差很大,達到±2.8%。顯然,氫氧化鈉不能準確滴定硼酸。
所示的曲線可以看出,氫氧化鈉滴定鹽酸時,等當點附近突躍大,表明加入少量氫氧化鈉引起較大的pH變化。因此,即使終點離等當點遠些(ΔpH為2.7pH單位),所引起的滴定誤差仍很小,只有 0.1%。在滴定硼酸時,等當點附近pH變化緩慢,說明要改變較大的pH需要加入較多的滴定劑,這時即使能找到在等當點變色的指示劑,但由於人眼判斷終點會產生0.3pH單位的誤差,即終點與等當點相差 ±0.3pH單位,所造成的滴定誤差很大,達到±2.8%。顯然,氫氧化鈉不能準確滴定硼酸。
 滴定誤差
滴定誤差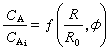
AcOH+OH-─→AcO-+H2O
式中Ka為酸離解常數;Kw為水的離子積。CEP為0.05Μ時,等當點的pH為8.72,若用酚酞作指示劑,終點的pH為9.0,此時ΔpH約為+0.3pH單位,按滴定誤差公式計算,滴定誤差為+0.02%。
由滴定誤差公式可得出能準確進行酸鹼滴定所應具備的條件。對一元酸(或鹼)的滴定分析,如果其濃度為0.1Μ,即CEP為0.05Μ,ΔpH為±0.3(這是使用指示劑確定終點的極限),允許滴定誤差為±0.2%,則要求Kt大於107,即被滴的酸(或鹼)的Ka(或Kb)應大於 10-7。
滴定誤差公式也適用於絡合滴定法,只要將ΔpH換成ΔpΜ(Μ為金屬離子濃度)即可。式中的 Kt表示絡合物的條件常數。用乙二胺四乙酸EDTA滴定時,一般濃度為0.02Μ,確定終點時至少有±0.2%誤差。如果要準確到±0.1%,則要求EDTA-金屬絡合物的條件穩定常數大於108。