簡介
 水的離子積
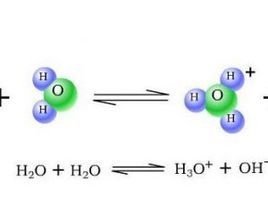
水的離子積實驗測得,25℃時1L純水中只有1×10^(-7)mol的水分子發生電離。1L純水的質量為1000g,它的物質的量近似為55.6mol,電離產生的H+為1×10^(-7)mol,55.6:1×10^(-7)=55.6×10^7:1,所以說55.6×10^7個水分子中約只有1個水分子電離。(即電離度為1:55.6×10^7)由水分子電離出的H+和OH-數目在任何情況下總相等,25℃時,純水中c(H+)=c(OH-)=1×10^(-7)mol/L。
c(H+)·c(OH-)=K(W),其中K(W)稱作水的離子積常數,簡稱水的離子積,c(H+)和c(OH-)是分別是指整個溶液中氫離子和氫氧根離子的總物質的量濃度.K(W)只隨溫度變化而變化,是溫度常數.如25℃,c(H+)=c(OH-)=1×10^(-7)mol/L,K(W)=1×10^(-14);100℃時,K(W)=1×10^(-12)。在其它物質的溶液中,如酸、鹼和鹽,由於溶質發生電離與水解,導致H+或OH-的濃度發生變化,抑制了水的電離,所以水的電離平衡也向左移動,因此可以利用水的離子積常數來簡單地判斷溶液的pH值。
稀酸溶液中c(H+)酸·c(OH-)水=1×10^(-14),稀鹼溶液中c(H+)水·c(OH-)鹼=1×10^(-14)。
方法
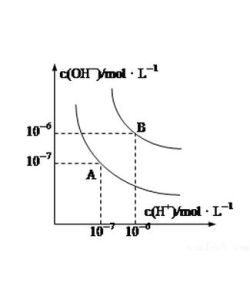
常溫下,稀溶液中c(H+)和c(OH-)的離子積總是1.0x10^(-14),知道c(H+)就可以計算出c(OH-),反之也一樣。在室溫下,酸鹼性與溶液中c(H+)和c(OH-)的關係如下:
1、酸性溶液中:c(H+)>c(OH-),c(H+)>1.0x10^(-7)mol/L
2、中性溶液中:c(H+)=c(OH-)=1.0x10^(-7)mol/L
3、鹼性溶液中:c(H+)<c(OH-),c(H+)<1.0x10^(-7)mol/L
因此,用c(H+)和c(OH-)都可以表示溶液的酸鹼性強弱。
pH與c(H+)之間的關係:pH是c(H+)的負對數,即:pH=-lgc(H+)。
參數
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 90 | 100 |
| Kw/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 38.0 | 55.0 |