簡介
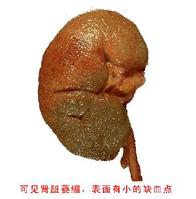 惡性腎小動脈硬化
惡性腎小動脈硬化惡性高血壓部分由原發性高血壓進展而來,另一部分則發生於繼發性高血壓,主要為腎實質性病變(慢性腎盂腎炎、急慢性腎小球腎炎)和腎血管性高血壓。腎臟是惡性高血壓最易累及的靶器官,表現為惡性小動脈性腎硬化症,病情兇險,不及時治療很快進入腎功能衰竭,可導致80%患者在兩年內死亡,故應引起廣大醫務人員的重視。
病症原因
惡性小動脈性腎硬化的發病與以下三個因素有關:
①血壓增高的直接作用:當血壓顯著升高時血管壁張力增大,使得血管內皮細胞損傷,通透性增強,血液中纖維素等成分滲入血管壁,產生小動脈的病理改變。
②腎素、血管緊張素的作用:在惡性小動脈性腎硬化時血中腎素和血管緊張素水平升高,提示其在發病中起一定作用。當高血壓引起腎血管損傷時,使得腎組織明顯缺血,激活腎素、血管緊張素系統,使腎素、血管緊張素產生增加,這又加劇了血壓升高和腎血管的病變,加重腎臟缺血,從而構成惡性循環。
③微血管內凝血:高血壓時血管壁的直接損傷作用,激活了凝血系統,使管壁發生血小板凝聚和纖維蛋白的沉積,刺激平滑肌細胞肥大和增生。同時血中的紅細胞在通過病變的血管時易損傷破壞,從而引起微血管內凝血和局部血管內溶血,加重腎小血管的損傷。在惡性小動脈性腎硬化時,腎血流量和GFR均顯著下降,腎內血流分布以腎皮質血流量下降明顯。廣泛的血管病變可使腎小球缺血、萎縮、纖維化。
病症診斷
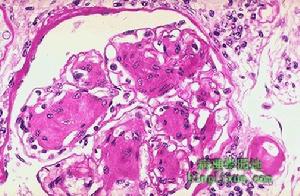 惡性腎小動脈硬化
惡性腎小動脈硬化血壓:血壓顯著升高,通常舒張壓在130mmHg(16.9kPa)以上,但血壓變動範圍大,舒張壓在100~180mmHg(13.3~24.0kPa),收縮壓在150~290mmHg(20.0~38.7kPa),大多既往存在良性高血壓數年。
眼底檢查:眼底視網膜改變屬於Keith-Wagner分級Ⅲ~Ⅳ級,包括眼底條紋狀、火焰狀出血,棉絮狀滲出和視乳頭水腫等,此乃惡性高血壓的特徵性表現,35%~60%患者出現視力受損。
腎臟損害:極為常見,但嚴重程度差異大。
尿液檢查 表現為突發性蛋白尿,1/3以上患者甚至出現大量蛋白尿(>3.5g/24h),20%患者出現肉眼血尿,50%表現為鏡下血尿,75%有無菌性白細胞尿,可出現紅細胞管型和顆粒管型。
腎功能檢查 31%左右患者有腎功能受損,血清肌酐水平>260μmol/L,尿蛋白排泄量高的患者往往血清肌酐水平也高。
腎臟病理檢查 光鏡下可見進球小動脈發生纖維素樣壞死,伴隨內皮下脂肪滴沉積和透明血栓形成,正常的血管中層結構消失,管壁可有輕度炎症浸潤;小葉間動脈和弓狀動脈肌內膜高度增生,細胞外基質明顯增加,基質與肌內膜細胞呈同心圓排列,形成“洋蔥皮”樣外觀,致使動脈管壁高度狹窄乃至閉塞;腎小球呈節段性纖維素樣壞死,局灶性系膜細胞增生,偶爾也可見新月體形成,輕度受累的腎小球則表現為基底膜皺縮和毛細血管襻塌陷,腎間質可表現為出血和灶性炎症伴纖維化,腎小管逐漸萎縮;此外可見腎小球旁器肥大,分泌腎素的顆粒細胞增生。免疫螢光檢查可見纖維素沉著於腎小球內及上述小動脈內,系膜區可有IgM、C3沉積。
其他器官損害:常伴隨心臟及中樞神經系統累及。急性心力衰竭、心絞痛和心肌梗死可發生在11%、4.1%、3.7%的患者身上,3/4以上患者有左心室肥大。腦血管意外發生率為7%,表現為局灶性腦梗塞、蛛網膜下腔或腦實質出血。
血液檢查:相當部分患者不存在貧血,反而由於低容量而表現為紅細胞壓積增高、血粘度增加。伴隨大量體液排出體外患者可出現低鉀性鹼中毒。大多數患者血漿腎素水平和活性以及醛固酮水平升高。可有微血管溶血證據,外周血片見紅細胞碎片,血小板減少,纖維蛋白降解產物增加,纖維蛋白原增加等。
病症治療
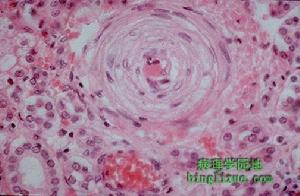 惡性腎小動脈硬化
惡性腎小動脈硬化降壓速度及目標:除了合併高血壓腦病、嚴重充血性心力衰竭、急性心肌梗死等的惡性高血壓需要儘快降低血壓外,大多數無併發症的惡性高血壓無需也應避免在短期內迅速將血壓降至正常,以防止腎臟及心腦缺血加重。通常血壓下降幅度在24h內不超過20%,血壓在24~48h內降至160~170/100~110mmHg(21.3~22.7/13.3~14.7kPa)為宜,對於有長期高血壓史及老年患者,降壓過程更宜緩慢。
降壓藥物的選擇:血管緊張素轉換酶抑制劑(ACEI)根據RAS在惡性高血壓發生髮展中所起的重要作用,不難理解ACEI作為首選藥物不僅具有良好的降壓作用,並能有效保護靶器官,改善血管損傷。口腔或舌下含服卡托普利10~50mg能有效治療惡性高血壓,其口服起效時間在15~30min內,若30min後未能觀察到血壓下降則ACEI對該患者可能無顯著降壓作用。除具有良好的降低系統血壓作用外,ACEI具有卓越的保護腎臟,改善血管損傷作用,包括(1)減輕AngⅡ介導的腎缺血,降低腎小動脈管壁壓力和血管通透性;(2)抑制血管平滑肌細胞肥大,減少細胞外基質產生;(3)影響腎血管加壓素受體的親合力;(4)減少緩激肽的降解,而緩激肽具有抗增殖和改善血管張力的作用;(5)升高血清鉀水平,已知高鉀飲食能降低血管內皮的通透性,抑制巨噬細胞對血管內皮的粘附,減少血管內膜的損害。ACEI在使用中需注意的是腎血管性惡性高血壓應禁用,繼發於腎實質病變腎功能已發生損害,血肌酐水平在40~50mg/L以上者也應禁用。對於低容量狀態的患者,ACEI會導致低血壓發生,故對此類患者應同時積極擴容治療。
血管緊張素ⅡⅠ型受體拮抗劑(AT1RA):通過阻斷AngⅡ的作用抑制RAS,因而適用於惡性高血壓。根據現有的研究資料,AT1RA具有與ACEI相似的降低血壓、保護靶器官的作用,由於能更徹底地抑制RAS,理論上比ACEI具有更強大的作用,但由於對緩激肽無明顯作用,其降壓作用受到一定影響。關於該類藥物在惡性高血壓治療中的療效評判目前尚缺乏有關資料。
柳胺心定:能同時阻斷α、β受體,並有直接擴血管作用,靜脈用藥往往效果顯著,並且具有作用迅速、持久,低毒性,無需進行侵入性血壓監測的優點。首劑予20~40mg,以後每10min可重複給藥並可逐漸加大給藥劑量,但不提倡首劑大劑量給藥。柳胺心定還可以持續靜脈滴注,1~2mg/min的給藥速度可在15min內降低血壓。口服柳胺心定100~400mg也可在1~3h內奏效。該藥在降低外周阻力的同時不會反射性刺激心排量,但會導致已有的左心功能不全惡化。
β-受體阻滯劑:該類藥物儘管在快速降低血壓方面作用不大,但由於能顯著減少腎素分泌,故而對具有高血漿腎素水平的惡性高血壓患者不失為理想的藥物。並且對於有心動過速、冠狀動脈病變的患者具有保護作用,與其他降壓藥物聯用能減輕藥物對心臟的反射性刺激。
血管擴張劑:肼苯噠嗪靜脈注射已被用於許多高血壓急症,長壓定5~20mg口服給藥也能在4h內發揮有效作用。但由於該類藥物能反射性激活腎上腺素能系統導致心動過速和(或)引起水鈉瀦留,故需要聯用β受體阻滯劑和(或)利尿劑,而冠狀動脈供血不足的患者則不宜使用。
鈣離子拮抗劑:通過擴張外周血管而產生降壓效應。雖然對心肌具有負性肌力作用,但由於能顯著降低外周阻力故能改善血流動力學,事實上該類藥物中的二氫吡啶類幾乎無負性肌力作用。在高血壓急症中最為常用的是硝苯吡啶,無論是口服、舌下含服或嚼碎後吞服均能起效,通常一次給藥即能較快起效,且無需進行侵入性血壓監測。此類藥物也會導致反射性交感神經興奮,產生心動過速,故在冠狀動脈供血不足的患者中禁用。緩釋硝苯吡啶和第二代二氫吡啶類藥物如尼卡地平引起反射性交感神經興奮的副作用小,在惡性高血壓合併腎功能衰竭的治療中非常有效。
容量平衡的維持:前已述及惡性高血壓往往存在血容量不足現象,因而降壓治療不提倡使用利尿劑,而且利尿劑能激活RAS進一步加重病情。在惡性高血壓的治療中,隨著降壓藥物作用的發揮,往往會出現血壓急劇下降甚至發生低血壓,因而積極地靜脈補充晶體對避免低血壓發生,改善臟器的血流灌注具有重要意義。有趣的是有研究發現部分惡性高血壓可通過水及鈉鹽的補充得以緩解,腎素的合成和釋放也減少。
急性腎功能不全的治療:惡性高血壓對腎功能影響的程度取決於有無基礎腎臟疾患及發病時腎功能水平。對於惡性高血壓發生時腎臟受累並不十分嚴重,血壓得到迅速有效控制的患者,腎功能可能恢復。如果血清肌酐水平在300μmol/L以上,腎功能急劇惡化的發生率相當高,恢復的可能性小。腎功能的恢復偶爾也會發生在接受透析後1周~2年以後。正因為腎功能恢復有如此大的潛力,積極、嚴格的抗高血壓治療十分必要。與此同時,需小心維持足夠的血容量以避免伴隨降壓治療而來的腎血流量下降。降壓藥物可選擇口服或靜脈用柳胺心定、緩釋硝苯吡啶、長壓定結合β-受體拮抗劑,ACEI也相當有效。降壓治療會減少腎小球濾過率、一過性加重腎功能不全,尤其是在容量不足的患者,而靜脈補充晶體擴容能改善腎臟灌注,故實屬必要,需引起重視。然而對於出現腎性水腫或終末期腎功能不全的患者,採用襻利尿劑或透析治療以排除過多體液能顯著降低血壓。在長期治療方面,嚴格控制血壓、採用生物相容性透析膜、避免使用腎毒性藥物、避免透析過程中低血壓事件的發生等將能最大程度地提供腎功能恢復的機會。由於腎功能恢復可以發生在相當後期,故腎移植主張延遲於發病12個月後進行。
