藥品簡介
藥品名稱:和美新
英文名:Topotecan Hydrochloride for Injection
 和美新
和美新藥物類別:植物類化療藥
活性成份:鹽酸托泊替康
化學名為:(S)-10[(二甲氨基)甲基]-4-乙基-4,9-二羥基-1H-吡喃[3’,4’:6,7]中氮茚[1,2-b]喹啉-3,14-(4H,12H)-二酮,單鹽酸鹽。
分子式為:C23H25N3O5·HCL。
分子量為:457.9
鹽酸托泊替康可溶於水,熔點為213-218oC。
生產廠商:史克必成藥廠。
藥理作用
 和美新
和美新拓撲異構酶I通過誘導可逆性DNA單鏈斷裂,使DNA螺旋鏈松解。托泊替康與拓撲異構酶I-DNA複合物結合,從而阻礙斷裂DNA單鏈的重新連線。托泊替康的細胞毒性作用認為是發生在DNA合成過程中,托泊替康-拓撲異構酶I-DNA形成的三元複合物與複製酶相互作用,造成雙鏈DNA的損傷。哺乳動物細胞無法有效地修復損傷的DNA雙鏈。
動力學
給於癌症患者0.5-1.5mg/m2的托泊替康輸注30分鐘時,托泊替康的藥代動力學特點為半衰期2-3小時,總藥時曲線下面積(AUC)與劑量基本呈正比。血漿蛋白結合率大約為35%。
代謝和排泄:pH值將影響托泊替康內酯結構的水解。內酯結構是托泊替康具有藥理活性的部分。在pH值為4時,托泊替康完全以內酯結構存在,而生理pH值條件下,則以開環羥基酸的結構存在。體外研究表明,極少量的托泊替康在人肝微粒體經N-去甲基化途徑代謝。在人體,腎臟是托泊替康主要的代謝途徑,約30%托泊替康經尿排泄。
特殊人群中托泊替康藥代動力學的變化:
性別-男性患者托泊替康的平均血漿清除率較女性高約24%。
老年人-對女性患者的藥代動力學研究表明,年齡對藥代動力學參數影響不大。腎臟清除率減低的老年人可延緩托
 托泊替康
托泊替康種族-尚無種族對托泊替康藥代動力學影響的研究結果。
腎功能不全-輕度腎功能不全(肌酐清除率40-60mL/分),托泊替康血漿清除率降至正常值的67%。中度腎功能不全(肌酐清除率20-39mL/分),托泊替康血漿清除率降至正常的34%,且半衰期輕度延長。對三例腎功能不全的患者研究表明,其平均半衰期為5小時。建議對腎功能不全病人調整劑量。
肝功能不全-肝功能不全的患者(血清膽紅素水平在1.7-15mg/dL之間)托泊替康血漿清除率降至正常值的67%,且半衰期輕度延長(從2.0小時增至2.5小時),但是這類肝功能不全的患者可以耐受正常推薦的托泊替康劑量。白細胞減少是限制托泊替康用量的主要因素,白細胞會隨托泊替康的劑量或AUC增加而減少。按托泊替康1.5mg/m2/日的劑量連用5天的方案給藥,首次療程後,白細胞最低可減低80-90%。臨床研究在本品治療452例復發或含鉑類藥物治療失敗的轉移性卵巢癌患者的4項臨床試驗中,治療起始劑量為1.5mg/m2/日,靜脈滴注30分鐘,連續5天,每21天為一個療程。對其中223例患者進行了托泊替康療效的評估(部分有生存期結果)。在隨機對照比較托泊替康和紫杉醇治療含鉑類藥物治療無效的或復發的轉移性卵巢癌病人試驗中,用本藥治療病人112例(1.5mg/m2/日x5天,每21天為一療程),紫杉醇治療病人114例(第1天用175mg/m2,靜脈滴注3小時,每21天為一療程)。對試驗治療無效或病變進展的病人,可給予交叉治療。用本藥組患者出現病情緩解時間平均為10周(範圍3.1-24.1周),長於紫杉醇組,平均為7周(範圍2.4-12.3周)。如果病人過早中止本藥的治療,將難於取得很好的療效。在交叉治療組,對於先接受紫杉醇治療,其後接受本藥治療的病人中,5/53(9.4%)患者的病情出現部分緩解;而在先接受本藥治療,其後接受紫杉醇治療的患者中,1/37(2.7%)出現病情完全緩解。對含鉑類藥物治療方案已耐藥,或完成鉑類藥物治療6個月內出現復發的病人,用本藥治療仍然有效。在60例病人中,1例完全緩解,7例部分緩解,緩解率為13%。在同一研究中,紫杉醇治療組無完全緩解者,4例部分緩解,緩解率為7%。對111例含鉑類藥物治療後復發的卵巢癌病人給予本藥治療,其病情緩解率為14%(95%可信區間7.9-20.9%);中位緩解期18周(範圍5-42周);進展時間8.4周(範圍:0.7-72.1周)。
用法用量
首次給藥:
患者首次使用和美新,其基礎中性粒細胞數需>=1500個/mm3,血小板數>=100,000個/mm3,血紅蛋白>=9g/dL。和美新的推薦劑量為每日一次,每次1.5mg/m2,靜脈滴注30分鐘,連續用藥5天,每21天為一個療程。建議至少
 和美新
和美新後續給藥:
只有當患者的中性粒細胞數恢復至1000個/mm3以上,血小板數恢復至100,000個/mm3以上和血紅蛋白恢復至9.0g/dL(必要時可輸血)以上時,才可再次接受和美新治療。若患者出現嚴重中性粒細胞減少症(中性粒細胞數低於1500個/mm3),並持續7天或更長時間;或出現嚴重中性粒細胞減少相關性發熱或感染,或因中性粒細胞減少而推遲治療,可按下述方案用藥:下一個療程給藥量減少至1.25mg/m2;或下一療程維持原給藥劑量,並於療程的第6天(完成和美新治療後24小時)給予G-CSF。如果G-CSF不能很好控制中性粒細胞的減少,則需降低給藥劑量。
因臨床支持資料有限,不推薦兒童患者使用本品。
肝功能不全患者:如果血漿膽紅素>1.5/dL且<10mg/dL,無需調整劑量。
腎功能不全患者:輕度腎功能不全病人(肌酐清除率40-60mL/分)無需調整劑量;中度腎功能不全病人(肌酐清除率20-39mL/分)推薦劑量調整為0.75mg/m2,重度腎功能不全病人尚無推薦劑量。
老年患者:腎功能正常的老年患者無需調整劑量。
不良反應
骨髓抑制(主要為中性粒細胞減少),這是托泊替康劑量限制性的毒性反應。表現為中性白細胞減少,血小板減少,貧血。
消化系統:噁心的發生率為77%(3-4度僅占10%)。嘔吐的發生率為58%(3-4度僅占9%)。用本藥治療的病人未接受常規預防性止吐治療。其中42%的病人出現腹瀉(3-4度僅占5%),39%的病人出現便秘(3-4度僅占
 注射用鹽酸托泊替康
注射用鹽酸托泊替康皮膚和附屬檔案:42%的病人出現脫髮(2度)。
中樞神經系統:21%的病人出現頭痛,是最常見的神經系統反應。9%的病人出現感覺異常,但通常僅為I度。
肝功能損害:5%的病人出現一過性SGOT/SAT和AST和SGPT/ALT升高(1度),少於1%的病人出現明顯的升高(3-4度),小於3%的病人出現血膽紅素升高。
呼吸系統:20%的病人出現呼吸困難,其中4%為3-4度。
注射液外漏:僅出現局部反應,如皮膚紅紫斑。
藥品上市後不良反應歸納如下:血液-罕見嚴重出血(與血小板減少有關)。
皮膚和附屬檔案:罕見嚴重皮炎,嚴重瘙癢。全身情況-少見過敏表現;罕見過敏反應,血管神經性水腫。
用藥禁忌
對本藥中任何成分有過敏反應史的病人,妊娠、哺乳或有重度骨髓抑制的病人。
警告:注射用本品需在富有化療經驗的醫生指導下使用。為及時有效地處理併發症,應在診斷和治療設施齊備的條件下使用本品。對中性粒細胞小於1500/mm3的病人禁止使用本品。對接受本品治療的患者,必須注意監測外周血細胞,以及早發現骨髓抑制現象。骨髓抑制主要表現為中性粒細胞減少,嚴重時可並發感染,甚至死亡。骨髓抑制(主要是中性粒細胞減少)是托泊替康劑量限制性毒性反應,但是中性粒細胞減少無累積現象。
 注射用鹽酸托泊替康
注射用鹽酸托泊替康血小板減少:26%的病人及9%療程出現4度血小板減少(<25,000/mm3),其中位持續時間為5天,血小板降至最低的中位時間為15天,無嚴重出血發生,對13%的病人及4%療程需要給予血小板輸注。
貧血:40%病人及16%療程出現重度貧血(3/4度,Hb<8g/dL),血紅蛋白降至最低的中位時間為第15天,56%病人及23%療程需要輸血。
骨髓功能監測:本品僅用於有一定骨髓儲備功能的病人,即病人在化療前的基礎中性粒細胞數需高於1,500/mm3,血小板數高於100,000/mm3。在使用本品治療中,應經常監測外周血細胞。只有當中性粒細胞數恢復至1,000/mm3以上,血小板數至100,000/mm3以上,血紅蛋白水平至9.0g/dL(若需要,可為輸血後指標),病人方可開始下一療程化療。本品與順伯合用有出現嚴重骨髓抑制的報告。
注意事項
與其他細胞毒性抗癌藥物一樣,配製本品靜脈輸液應在垂直層流空氣的通風櫥內進行,並戴手套和口罩。如本品污染皮膚或粘摸,應立即用水和肥皂徹底沖洗。
配製方法:每瓶含4mg鹽酸托泊替康,先用4mL無菌注射用水將其溶解。在使用前,按推薦劑量抽取上述配製的本品溶液,
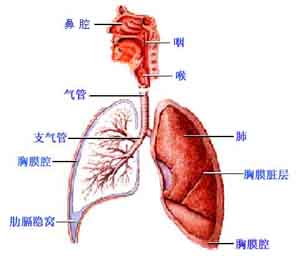 呼吸系統
呼吸系統致癌、致突變及生殖毒性:尚未進行托泊替康的致癌試驗。托泊替康對哺乳動物細胞有生殖毒性,並可能有致癌作用。托泊替康能誘導L5178y小鼠淋巴瘤細胞和人培養淋巴細胞發生裂變,可伴或不伴有代謝活性改變。托泊替康可引起小鼠骨髓裂變。托泊替康不引起細菌的突變。
對妊娠和哺乳的影響:本藥屬妊娠類型D,孕婦使用本品可對胎兒造成危害。儘管無托泊替康對妊娠婦女影響的資料,若在病人妊娠期使用托泊替康或在用藥期間妊娠,應告戒病人該藥物對胎兒具有潛在危害。應告知育齡婦女在化療中避孕。給予孕6-20天家兔本品0.1mg/kg/日(大約相當於mg/m2的基礎臨床劑量),可引起毒性反應,造成胚胎死亡或胎兒體重減輕。給與交配前至孕6天鼠本品0.23mg/kg/日(約相當於mg/m2的基礎臨床劑量)共14天,可出現胚胎吸收,胎兒小眼,著床前流產及母鼠輕度的毒性反應。給孕6-17天鼠本品0.1mg/kg/日(大約相當於mg/m2的基礎臨床劑量的半量),可導致胚胎著床後死亡率和胎兒畸形的增加。最常見的畸形部位是顱骨、椎骨、眼(眼小、無眼、視網膜玫瑰化樣物形成、視網膜缺損、異位眼窩)和腦(側腦室和第三腦室擴張)。尚不清楚本品是否經人乳分泌。哺乳期婦女接受本品治療時應停止哺乳。
對兒童的影響:尚缺乏本品在兒童套用的安全性和有效性研究資料。
過量處理
尚無治療本品過量的解毒藥。
相互作用
目前尚無托泊替康與其它藥物間相互作用的藥代動力學研究。
體外試驗結果表明:托泊替康不改變P450,CYP1A2,CYP2Ab,CYP2c8/9.CYP2c19,CYP2E,CYP3A,CYP4A或二氫嘧啶脫氫酶的活性。尚無托泊替康對體內酶抑制作用的資料。托泊替康與G-CSF同時使用可延長中性粒細胞減少的持續時間,所以應在治療的第6天,既在完成本品治療後24小時才開始使用G-CSF。在I期臨床試驗中,本品與順伯聯合套用可出現嚴重的骨髓抑制。給3例病人順鉑50mg/m2和本品1.25mg/m2/日,用藥5天,其中一例出現中性粒細胞減少持續12天,一例死於白細胞減少性敗血症。尚無足夠的資料說明本品與順鉑合用是安全有效的。
臨床套用
和美新的標準用藥方案為每天1.5mg/m2,連續5天,間隔21天重複療程。臨床經驗顯示,這一方案對於一些患者而言,尤其是對那些曾接受過大劑量鉑劑治療的患者,可能毒性太大,據此曾有人建議將初始計量降低為每天1.0~1.25mg/m2。
 消化系統
消化系統對於復發性卵巢癌,化療常常是首選的治療方法,具有重要的地位。卵巢癌的一線化療公認的首選方案為紫杉醇+卡鉑(TC)。2001年,Gore等的研究結果顯示,和美新與紫杉醇治療晚期卵巢癌療效相當,兩組間無顯著差異;亞組分析顯示和美新對鉑類藥物耐藥的患者療效優於紫杉醇。
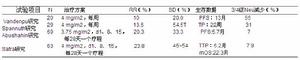
2007年,Vandenput、Abushahin、Spannuth和Safra相繼報導了對鉑劑治療後復發的卵巢癌患者進行了和美新單藥治療的研究結果(見表1)。Vandenput等認為,每周1次和美新治療反應毒性低於每3周方案(d1~5);儘管10%的緩解率不高,但在這些難治性病例中我們也不能期望更高。Spannuth等的研究結論也提示,在鉑類化療敏感型復發性卵巢上皮癌患者中,和美新4mg/m2每周1次方案作為三線療法具有適度的臨床療效;和美新的劑量限制性毒性是可接受的,可給予造血生長因子支持療法、減少劑量或改變給藥方案。與前兩位學者的研究略有不同,Abushahin等的研究重點揭示了不良反應,在他們的研究中3~4度血液毒性中的中性粒細胞減少只占7%。同樣,Safra等也得出,對於復發性卵巢癌和原發性腹膜癌患者,套用和美新每周療法可取得較好的生存數據;對患者而言,和美新每周1次方案較3周方案(d1~5)更為方便;和美新每周方案具有更好的耐受性。
表1各研究和美新每周療法治療復發卵巢癌總結
 和美新
和美新綜上,和美新d1,d8,d15每4周方案治療復發卵巢癌有效,血液學毒性較3周(d1~5)方案明顯降低;RR=20.3%~23.8%;SD=33.3%~54%;3/4度血液毒性7%左右。
和美新每周方案治療復發卵巢癌目前正在進行的Ⅱ/Ⅲ期研究。
