哈米特方程
正文
表達反應速率與反應物結構間定量關係的一個方程式。由L.P.哈米特於1937年首先提出。該方程在有機結構理論中很重要。在芳香族化合物,特別是苯類化合物的反應中,若不含取代基的反應物的反應速率常數為k0,當引入取代基後,其反應速率常數為k,則k與k0之間有如下關係:
lgk=lgk0+σρ
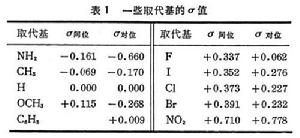
這就是哈米特方程,式中σ為取代常數,其值決定於取代基團的性質和位置(如鄰位、間位、對位);ρ為常數,決定於反應類型。哈米特方程的另一種形式是描述反應平衡常數的關係,即:
lgK=lgK0+σρ
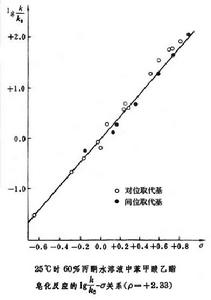
式中K0為不含取代基的反應物的平衡常數;K為含取代基的反應物的平衡常數。規定氫的σ值為0.00,苯甲酸和取代苯甲酸的水溶液在25℃時電離反應的ρ為1。根據苯甲酸的電離常數K0和取代苯甲酸的電離常數K:
 哈米特方程
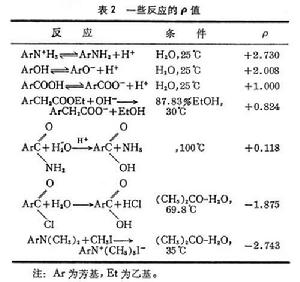
哈米特方程根據已求得的σ值,可用哈米特方程求得各反應的ρ值。表2列出了部分反應的ρ值。ρ值可為<0、0、0<ρ<1、≥1等各種可能的數值。近年來,人們認為ρ 的數值與反應過渡態的荷電情況有關。當過渡態與反應物相比具有正電性時,則ρ<0;具有負電性時,則ρ>0;電性無變化時,則ρ=0。如果與ρ=1的標準反應相比,則ρ<1表明該反應在過渡態時的電荷改變比標準反應具有更強的正電性,ρ值越小,則正電性越強;ρ>1時,則過渡態之電荷改變比標準反應具有更強的負電性,ρ值越大,則負電性越強。根據ρ值可判斷反應過渡態的可能狀況。測定反應的ρ值,已成為研究有機反應機理的有效手段之一。
 哈米特方程
哈米特方程高振衡編:《物理有機化學》,人民教育出版社,北京,1982。