雜化理論概要
核外電子在一般狀態下總是處於一種較為穩定的狀態,即基態。而在某些外加作用下,電子也可以吸收能量變為一個較活躍的狀態,即激發態。在形成分子的過程中,由於原子間的相互影響,在能量相近的兩個電子亞層中的單個原子中,能量較低的一個或多個電子會激發而變為激發態,進人能量較高的電子亞層中,即所謂的躍遷現象,從而形成一個或多個能量較高的電子亞層。此時,這一個與多個原來處於較低能量的電子亞層的電子所具有的能量增加到和原來能量較高的電子亞層中的電子相同。這樣,這些電子的軌道便混雜在一起,這便是雜化,而這些電子的狀態也就是所謂的雜化態。
簡言之,即某原子成鍵時,在鍵合原子的作用下,價層中若干個能級相近的原子軌道有可能改變原有的狀態,混雜起來並重新組合成一組有利於成鍵新軌道,稱為雜化軌道。這一過程稱為原子軌道的雜化,簡稱雜化。
同一原子中能量相近的n個原子軌道.組合後只能得到n個雜化軌道。例如,同一原子的1個s軌道和1個p軌道,只能雜化成2個SP雜化軌道。雜化軌道與原來的原子軌道相比,其角度分布及形狀均發生了變化,能量也趨於平均化。但比原來未雜化的軌道成鍵能力強,形成的化學鍵的鍵能大,使生成的分子更穩定。
分類
等性雜化:參與雜化的軌道完全相同的雜化叫做等性雜化。
不等性雜化:參與雜化的軌道不完全相同的雜化叫做不等性雜化。
雜化軌道的類型取決於原子所具有的價層軌道的種類和數目以及成鍵數目等。常見的有:
sp雜化:sp雜化是指由原子的一個ns和一個np軌道雜化形成兩個sp雜化軌道,每個sp雜化軌道各含有1/2s成分和1/2p成分,兩個軌道的伸展方向恰好相反,互成180度夾角,形成σ鍵。直線型。
sp 雜化:原子以一個ns和兩個np軌道雜化,形成三個能量相同sp 雜化軌道,每個雜化軌道各含1/3s成分和2/3p成分。三個雜化軌道間的夾角為120度。
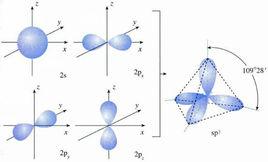
sp 雜化:由一個ns和三個np軌道雜化形成四個能量等同的sp3雜化軌道。每個sp3軌道都含有1/4s成分和3/4p成分,構型為正四面體。
sp d雜化:由一個ns、三個np軌道和一個nd軌道雜化形成五個能量等同的sp d雜化軌道。每個sp3d軌道都含有1/5個s、3/5個p和1/5個d成分,構型為三角雙錐。
sp d 雜化:由一個ns、三個np軌道和二個nd軌道雜化形成六個能量等同的sp d 雜化軌道。每個sp d 軌道都含有1/6個s、1/2個p和1/3個d成分,構型為面體。
判斷方式
以下以H2S為例,判斷公式,k=m+n:
當k=2,sp雜化;
k=3,sp 雜化;
k=4,sp 雜化;
k=5,sp d雜化;
k=6,sp d 雜化;
其中n值為AB中的n,與中心原子結合的原子數(此時n是HS中的2)。中心原子,就是分子形成是被當做中心的原子,HS的中心原子為S。
m=(e-nd)/2
m:孤電子對數(指未成鍵電子)
e:中心原子價電子數(價電子數就是最外層電子數,S的e=6)
n:與中心原子結合的原子數
d:與中心原子結合的原子最多能接收的電子數(與中心原子結合的原子指H原子,最外層差1 個電子排滿,此處d=1)。
於是,HS的k=m+n=2+(6-2×1)/2=4 故HS是sp 雜化。