基本介紹
雜化軌道理論(hybrid orbital theory)是1931年由萊納斯·鮑林(Pauling L)等人在價鍵理論的基礎上提出的。雖然它實質上仍屬於現代價鍵理論,但是它在成鍵能力、分子的空間構型等方面豐富和發展了現代價鍵理論。
核外電子在一般狀態下總是處於一種較為穩定的狀態,即基態。而在某些外加作用下,電子也是可以吸收能量變為一個較活躍的狀態,即激發態。在形成分子的過程中,由於原子間的相互影響,單個原子中,具有能量相近的兩個能級中,具有能量較低的能級的一個或多個電子會激發而變為激發態,進入能量較高的能級中去,即所謂的躍遷現象,從而新形成了一個或多個能量較高的能級。此時,這一個或多個原來處於較低能量的能級的電子所具有的能量增加到與原來能量較高的能級中的電子相同。這樣,這些電子的軌道便混雜在一起,這便是雜化,而這些電子的狀態也就是所謂的雜化態。
用化學語言講,雜化軌道理論從電子具有波動性、波可以疊加的觀點出發,認為一個原子和其他原子形成分子時,中心原子所用的電子軌道不是原來純粹的s軌道或p軌道,而是若干不同類型、能量相近的電子軌道經疊加混雜、重新分配軌道的能量和調整空間伸展方向組成的同等數目的能量完全相同的新的電子軌道——雜化軌道,以滿足化學結合的需要。這一過程稱為電子軌道的雜化。
基本要點
1、 某原子在成鍵時,在鍵合原子的作用下,同一原子中不同類型能量相近的原子軌道可能改變原有的狀態,混雜起來並重新組合成一組有利於成鍵的新軌道(即雜化軌道)。 這一過程稱為原子軌道的雜化,簡稱雜化。
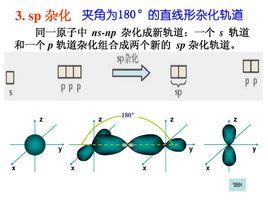
2 、同一原子中能量相近的n 個原子軌道,組合後只能得到n個雜化軌道。例如,同一原子的一個ns 軌道和一個np軌道,只能雜化成兩個sp雜化軌道。這兩個sp雜化軌道的形狀一樣,但其角度分布最大值在x軸上的取向相反。
3 、雜化軌道比原來未雜化的軌道成鍵能力強,形成的化學鍵鍵能大,使生成的分子更穩定。 由於成鍵原子軌道雜化後,軌道角度分布圖的形 狀發生了變化,形成的雜化軌道一頭大一頭小。大的一頭與別的原子成鍵時電子云可以得到更大程度的重疊 ,所以形成的化學鍵比較牢固。
理論說明
(1)s-p型雜化
只有s軌道和p軌道參與的雜化,主要有以下三種類型:sp 雜化,sp 雜化 ,sp 雜化。
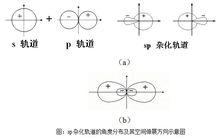 sp雜化軌道角度分布及其空間伸展方向示意圖
sp雜化軌道角度分布及其空間伸展方向示意圖(2)s-p-d型雜化
ns軌道,np軌道,nd軌道一起參與雜化稱為s-p-d型雜化,主要有以下幾種類型:
sp d雜化:由一個ns、三個np軌道和一個nd軌道雜化形成五個能量等同的sp d雜化軌道。每個sp d軌道都含有1/5個s、3/5個p和1/5個d成分。構型為三角雙錐。 sp d 雜化:由一個ns、三個np軌道和二個nd軌道雜化形成六個能量等同的sp d 雜化軌道。每個sp d 軌道都含有1/6個s、1/2個p和1/3個d成分。構型為八面體。
此外還有以內層的(n-1)d軌道,ns軌道,np軌道一起參與的雜化方式,它主要存在於過渡金屬配位化合物中,例如d sp 雜化、d sp 雜化等。
(3)等性雜化和不等性雜化
雜化過程中形成雜化軌道可能是一組能量的並軌道,也可能是一組能量彼此不相等的軌道。因此,軌道的雜化方式可分為等性雜化和不等性雜化。
空間形態
幾種雜化軌道之後的分子空間形態
sp雜化:直線形 如:CO、CS、BeCl、HgCl、CH
sp2雜化:平面三角形(等性雜化為平面正三角形) 如:BCl;正六邊形 如:石墨
sp3雜化:空間四面體(等性雜化為正四面體) 如:CH、CCl
sp3d雜化:三角雙錐 如:PCl
sp3d2雜化:八面體(等性雜化為正八面體)如SF
sp3d3雜化:五角雙錐 如:IF
dsp2雜化:平面四方形(等性雜化為正方形) 如:Pt(NH)Cl(順鉑)
註: 中心原子有孤對電子的還要視孤對電子對數而定具體的空間結構 如:HO為V形(角形)
相關種類
軌道雜化一般發生在s軌道與p軌道之間,簡稱為sp型雜化。這類雜化軌道種類很多。可分為sp 、sp 、sp 三種。
如三氯化硼(BCl)分子中B有sp 雜化軌道,即由1個s軌道和2個p軌道組合成3個sp 雜化軌道,在氯化鈹(BeCl)中有sp雜化軌道,在過渡金屬化合物中還有d軌道參與的sp d和sp d 雜化軌道等。以上幾例都是闡明了共價單鍵的性質,至於乙烯和乙炔分子中的雙鍵和三鍵的形成,又提出了σ鍵和π鍵的概念。如把兩個成鍵原子核間聯線叫鍵軸,把原子軌道沿鍵軸方向“頭碰頭”的方式重疊成鍵,稱為σ鍵。把原子軌道沿鍵軸方向“肩並肩”的方式重疊,稱為π鍵。例如在乙烯(CH= CH)分子中有碳碳雙鍵(C=C),碳原子的激發態中2p,2p和2s形成sp2雜化軌道,這3個軌道能量相等,位於同一平面並互成120℃夾角,另外一個p軌道未參與雜化,位於與平面垂直的方向上。碳碳雙鍵中的sp 雜化如下所示。
這3個sp 雜化軌道中有2個軌道分別與2個H原子形成σ單鍵,還有1個sp 軌道則與另一個C的sp 軌道形成頭對頭的σ鍵,同時位於垂直方向的p軌道則以肩並肩的方式形成了π鍵。也就是說碳碳雙鍵是由一個σ鍵和一個π鍵組成,即雙鍵中兩個鍵是不等同的。π鍵原子軌道的重疊程度小於σ鍵,π鍵不穩定,容易斷裂,所以含有雙鍵的烯烴很容易發生加成反應,如乙烯(HC=CH)和氯(Cl)反應生成氯乙烷(Cl—CH—CH—Cl)。
乙炔分子(CH)中有碳碳叄鍵(HC≡CH),激發態的C原子中2s和2p軌道形成sp雜化軌道。這兩個能量相等的sp雜化軌道在同一直線上,其中之一與H原子形成σ單鍵,另外一個sp雜化軌道形成C原子之間的σ鍵,而未參與雜化的p與p則垂直於x軸並互相垂直,它們以肩並肩的方式與另一個C的p,p形成π鍵。即碳碳三鍵是由一個σ鍵和兩個π鍵組成。這兩個π鍵不同於σ鍵,軌道重疊也較少並不穩定,因而容易斷開,所以含三鍵的炔烴也容易發生加成反應。
舉例說明
以CH4分子的形成為例。
基態C原子的外層電子構型為2s 2p 2p 。在與H原子結合時,2s上的一個電子被激發到2p軌道上,C原子以激發態2s 2p 2p 2p 參與化學結合。當然,電子從2s激發到2p上需要能量,但由於可多生成二個共價鍵,放出更多的能量而得到補償。
在成鍵之前,激發態C原子的四個單電子分占的軌道2s、2p、2p、2p會互相“混雜”,線性組合成四個新的完全等價的雜化軌道。此雜化軌道由一個s軌道和三個p軌道雜化而成,故稱為sp 雜化軌道。經雜化後的軌道一頭大,一頭小,其方向指向正四面體的四個頂角,能量不同於原來的原子軌道。
形成的四個sp 雜化軌道與四個H原子的1s原子軌道重疊,形成(sp -s)σ鍵,生成CH分子。
由於雜化軌道的電子云分布更為集中,雜化軌道的成鍵能力比未雜化的各原子軌道的成鍵能力強,故形成CH分子後體系能量降低,分子的穩定性增強。