sp雜化
同一原子內由1個ns 軌道和 1個 np 軌道參與的雜化稱為sp雜化 ,所形成的兩個雜化軌道稱為SP雜化軌道。每個sp 雜化軌道含有1/2的S成分和 1/2的 p成分,雜化軌道間的夾角為180°。sp軌道雜化是基於軌道雜化理論的一個重要分支,是一種比較常見的軌道雜化方式。
雜化過程
以BeCl的形成過程為例說明sp雜化過程。基態 Be的外層電子構型為2s2,在成鍵時先發生激發,成為激發態2s12p1。隨即發生雜化,即 Be的1個2s 軌道和1個2p軌道進行sp雜化,形成兩個sp雜化軌道,每個雜化軌道中各有一個未成對電子。兩個Cl原子的3p1軌道以“頭頂頭”方式與各雜化軌道大的一端重疊,形成兩個σ鍵。由於 Be的兩個sp雜化軌道間的夾角是180°,因此所形成的BeCl的幾何構型為直線形。HgCl& II B 族元素的其他AB型直線型分子的形成與上述過程相似。
注意事項
(1)原子軌道的雜化只有在形成分子的過程中才會發生;
(2)能量相近的原子軌道間才能發生雜化,能量相近通常是指:ns與np、ns,np與nd或(n-1)d。
sp2雜化
同一原子內由1個ns軌道和2個np軌道參與的雜化稱為sp2雜化,所形成的3個雜化軌道稱為sp2雜化軌道。各 含有1/3的s成分和2/3的p成分,雜化軌道間的夾角為120°,呈平面正三角形。
乙烯
乙烯是最普遍的sp2雜化形式,碳原子在形成乙烯分子時,每個碳原子的2s軌道與兩個2p軌道發生雜化,稱為sp2雜化,其形狀與sp3雜化軌道相似,在空間以碳原子為中心指向平面三角形的三個頂點。未雜化的一個2p軌道則垂直與雜化軌道的平面。三個sp2雜化軌道與未雜化的一個2p軌道各有一個未成對電子。兩個碳原子分別以一個sp2雜化軌道互相重疊形成σ鍵,兩個碳原子的另外兩個sp2雜化軌道分別與氫原子結合。所有碳原子和氫原子在同一平面上,而兩個碳原子未雜化的2p軌道垂直於這個平面。它們互相平行,彼此肩並肩重疊形成Π鍵。所以,在乙烯分子中是以雙鍵結合,雙鍵由一個σ鍵與一個Π鍵構成。
苯環
苯環中的每個碳原子採用sp2雜化方式,每個碳原子都有一未參加雜化的p軌道。由於苯是平面分子,因此6個未參加雜化的p軌道互相平行。所以苯分子中有大Π鍵。
氟化硼
實驗測知BF的4個原子在同一平面上,鍵角∠FBF等於120°。B原子的外層電子構型是2s22p1,成鍵時1個2s電子激發到1個空的2p軌道上,與此同時,1個s軌道和2個p軌道“混合”起來成為3個雜化軌道,分別與3個F原子成鍵。
sp3雜化
sp3雜化一般發生在分子形成過程中。雜化發生後,原子最外層s軌道中的一個電子被激發至p軌道,使將要發生雜化的原子進入激發態;之後,該層的s軌道與三個p軌道發生雜化。此過程中,能量相近的s軌道和p軌道發生疊加,不同類型的原子軌道重新分配能量並調整方向,形成4個等價的sp3軌道。
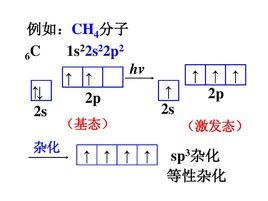
例如,CH的形成,基態C原子只有兩個未成 對電子 ,在形成CH時 ,在H的影響下,C的1個2S軌道和3個 2p軌道進行sp3雜化,形成4個sp3雜化軌道,每個Sp3雜化軌道中各有一個未成對電子。C用4個Sp3雜化軌道分 別與4個H的1s軌道重疊形成4個σ鍵。由於C的4個sp3雜化軌道間的夾角為109°28',所以生成的CH的幾何構型為正四面體。
sp3d雜化
由一個ns、三個np軌道和一個nd軌道雜化形成五個能量等同的sp3d雜化軌道。每個sp3d軌道都含有1/5個s、3/5個p和1/5個d成分,構型為三角雙錐。
sp3d2雜化
由一個ns、三個np軌道和二個nd軌道雜化形成六個能量等同的sp3d2雜化軌道。每個sp3d2軌道都含有1/6個s、1/2個p和1/3個d成分,構型為面體。
等性雜化
定義
在雜化過程中形成的每一種雜化軌道所含的s及p的成分相等, 這樣的雜化稱為等性雜化,形成的雜化軌道為等性雜化軌道。
舉例
如BeCl、BF、CH等分子為等性雜化。基 態 Be的外層電子構型為2s2,在成鍵時先發生激發,成為激發態2s12p1。隨即發生雜化,即 Be的1個2s 軌道和1個2p 軌道進行sp雜化,形成兩個sp雜化軌道,每個雜化軌道中各有一個未成對電子。兩個C1原子的3p1軌道以“頭頂頭”方式與各雜化軌道大的一端重疊,形成兩個σ鍵。由於 B e的兩個sp雜化軌道間的夾角是180°,因此所形成的BeCl的幾何構型為直線形。基態C原子只有兩個未成對電子,在形成CH時 ,在H的影響下,C的1個2S軌道和3個2p軌道進行sp3雜化,形成4個sp3雜化軌道,每個Sp3雜化軌道中各有一個未成對電子。C用4個Sp3雜化軌道分別與4個H的1s軌道重疊形成4σ鍵。由於C的4個sp3雜化軌道間的夾角為109°28',所以生成的CH的幾何構型為正四面體。
不等性雜化
定義
在雜化過程中形成的各新雜化軌道所含s和p的成分不相等,這樣的雜化稱為不等性雜化,形成的雜化軌道為不等性雜化軌道。
形成過程
眾所周知,將同一個原子的若干不同類型的原子軌道“ 混合” 起來, 重新組成一組新原子軌道的過程叫原子軌道的雜化,而形成的一組新軌道叫雜化軌道。當形成的一組雜化軌道完全等同(成分相等,能量相同時,這種雜化又叫等性雜化,否則為不等性雜化。對於這一點,各種教科書中的說法是相一致的。但是,對於如何引起雜化軌道中成分不等而形成不等性雜化卻各有評說。
第一種觀點認為:凡是由於雜化軌道中有不參加成鍵的孤電子對的存在,而形成不完全等同的雜化軌道,這種雜化叫不等性雜化。這也是多種《無機化學》教科書上較普遍的說法。
第二種觀點則認為:對於不等性雜化,不僅要考慮中心原子是否有孤對電子,而且還要考察與中心原子相互作用的其它原子的影響。若中心原子A 與完全相同的原子或基團B形成共價鍵,由於所形成的鍵都一樣,A 原子軌道一般採取等性雜化,若中心原子A 與不相同的其它原子或基團B和C同時結合,就會形成不同的鍵而出現不等性雜化。
第三種觀點是:當中心原子參與雜化的軌道除了有被成單電子占據的外,在還有空軌道時, 則認為中心原子也採取了不等性雜化。如分子中每個B原子採取了不等性雜化,其中三個雜化軌道各占有一個成單電子,而有一個雜化軌道是空的。
第四種觀點認為:不等性雜化又分為有孤對電子參加的雜化和沒有孤對電子參加的雜化(又叫部分雜化)兩種類型。所謂部分雜化是指中心原子成鍵的原子軌道只有一部分原子軌道參加雜化,且生成鍵,而未雜化的原子軌道形成π鍵。