定義
同一原子內由1個ns軌道和2個np軌道參與的雜化稱為sp 雜化,所形成的3個雜化軌道稱為sp 雜化軌道。各含有1/3的s成分和2/3的p成分,雜化軌道間的夾角為120°,呈平面正三角形。
具體形成過程
乙烯
 sp2雜化
sp2雜化 sp2雜化
sp2雜化 sp2雜化
sp2雜化 sp2雜化
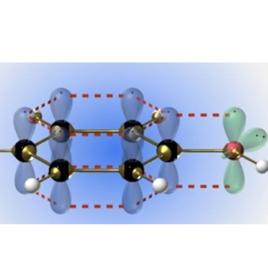
sp2雜化乙烯是最普遍的sp 雜化形式,碳原子在形成乙烯分子時,每個碳原子的2s軌道與兩個2p軌道發生雜化,稱為sp 雜化,其形狀與sp3雜化軌道相似,在空間以碳原子為中心指向平面三角形的三個頂點。未雜化的一個2p軌道則垂直與雜化軌道的平面。三個sp 雜化軌道與未雜化的一個2p軌道各有一個未成對電子。兩個碳原子分別以一個sp 雜化軌道互相重疊形成 鍵,兩個碳原子的另外兩個sp 雜化軌道分別與氫原子結合。所有碳原子和氫原子在同一平面上,而兩個碳原子未雜化的2p軌道垂直於這個平面。它們互相平行,彼此肩並肩重疊形成 鍵。所以,在乙烯分子中是以雙鍵結合,雙鍵由一個 鍵與一個 鍵構成。
苯環
 sp2雜化
sp2雜化 sp2雜化
sp2雜化 sp2雜化
sp2雜化苯環中的每個碳原子採用sp 雜化方式,每個碳原子都有一未參加雜化的p軌道。由於苯是平面分子,因此6個未參加雜化的p軌道互相平行。所以苯分子中有 型大 鍵。
BF3
實驗測知BF的4個原子在同一平面上,鍵角∠FBF等於120°。B原子的外層電子構型是2s 2p ,成鍵時1個2s電子激發到1個空的2p軌道上,與此同時,1個s軌道和2個p軌道“混合”起來成為3個雜化軌道,分別與3個F原子成鍵。
注意事項
(1)原子軌道的雜化只有在形成分子的過程中才會發生;
(2)能量相近的原子軌道間才能發生雜化,能量相近通常是指:ns與np、ns,np與nd或(n-1)d。