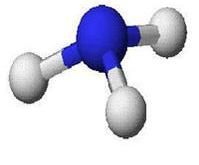
分子結構
氮原子有5個價電子,其中有3個未成對,當它與氫原子化合時,每個氮原子可以和3個氫原子通過極性共價鍵結合成氨分子,氨分子裡的氮原子還有一個孤對電子。氨分子的空間結構是三角錐型,極性分子。
物理性質
相對分子質量17.031
氨氣在標準狀況下的密度為0.771g/L
臨界點132.4℃
蒸汽壓506.62kPa(4.7℃)
熔點-77.7℃;沸點-33.5℃
溶解性:極易溶於水(1:700)
相對密度(水)0.82(-79℃)
相對密度(空氣)0.5971
自燃點651.1℃
臨界壓力11.2mPa
臨界體積72.47cm3/mol
臨界密度0.235g/cm3
臨界壓縮係數0.242
液體熱膨脹係數,25℃時0.00251/℃
表面張力,25℃時19.75×10-3N/m,19.75dyn/cm
汽化熱,沸點下1336.97kj/kg,574.9BTU/1b
熔化熱,熔點下332.16kj/kg,142.83BTU/1b
氣體定壓比熱容cp,25℃時2.112kj/(kg*k),0.505BTU/(1b·R)
氣體定容比熱容cp,25℃時1.624kj/(kg*k),0.388BTU/(1b·R)
氣體比熱容比,cp/cv1.301
氣體摩爾熵,25℃時192.67j/(mol*k)
氣體摩爾生成焓,25℃時-45.9kj/mol
氣體黏度,25℃時101.15×10-7Pa*s,101.15μP
液體黏度,25℃時0.135mPa*s,0.082cp
燃燒熱,25℃(77oF)氣態時18603.1kj/kg,7999.3BTU/1b
空氣中爆炸低限含量16.1%(φ)
空氣中爆炸高限含量25%(φ)
化學性質
(1)跟水反應
氨溶於水時,氨分子跟水分子通過氫鍵結合成一水合氨(NH3•H2O),一水合氨能小部分電離成銨離子和氫氧根離子,所以氨水顯弱鹼性,能使酚酞溶液變紅色。氨在水中的反應可表示為:一水合氨不穩定受熱分解生成氨和水,氨水中存在三分子、三離子。
分子:NH3、NH3•H2O、H2O;
離子:NH4+、OH-、H+;
氨水在中學化學實驗中三套用
①用蘸有濃氨水的玻璃棒檢驗HCl等氣體的存在;②實驗室用它與鋁鹽溶液反應制氫氧化鋁;③配製銀氨溶液檢驗有機物分子中醛基的存在。
(2)跟酸反應
2NH3+H2SO4===(NH4)2SO4
3NH3+H3PO4===(NH4)3PO4
NH3+CO2+H2O===NH4HCO3
(反應實質是氨分子中氮原子的孤對電子跟溶液里具有空軌道的氫離子通過配位鍵而結合成離子晶體。若在水溶液中反應,離子方程式為:
8NH3+3Cl2===N2+6NH4Cl(黃綠色褪去,產生白煙),可利用此反應檢驗氯氣管道是否泄漏。
反應實質:2NH3+3Cl2===N2+6HCl
NH3+HCl===NH4Cl
總反應式:8NH3+3Cl2===N2+6NH4Cl
(3)和氧氣反應
氨在催化劑加熱條件下和空氣中的氧氣反應,生成一氧化氮和水。
4NH3+5O2=4NO+6H2O
該反應為工業制硝酸的第一步。
(4)催化氧化
4NH3+5O2=催化劑加熱=4NO+6H2O
該反應是放熱反應,是工業制硝酸的第一步。
(5)與碳的反應
NH3+C=加熱=HCN+H2(劇毒氰化氫)
(6)液氨的自偶電離
液氨的自偶電離為:2NH3==(可逆)NH2+NH4K=1.9×10^-30(223K)
(7)取代反應
取代反應的一種形式是氨分子中的氫被其他原子或基團所取代,生成一系列氨的衍生物。另一種形式是氨以它的氨基或亞氨基取代其他化合物中的原子或基團,例如:
COCl2+4NH3==CO(NH2)2+2NH4Cl
HgCl2+2NH3==Hg(NH2)Cl+NH4Cl
這種反應與水解反應相類似,實際上是氨參與的複分解反應,故稱為氨解反應。
(8)與水、二氧化碳
NH3+H2O+CO2==NH4HCO3
此反應可逆,碳酸氫銨受熱會分解
NH4HCO3=(加熱)=NH3+CO2+H2O
(9)與氧化物反應
3CuO+2NH3==加熱==3Cu+3H2O+N2
這是一個氧化還原反應,採用氨氣與氧化銅共熱,體現了氨氣的還原性。
(10)氨水(NH3·H2O)對大部分物質沒有腐蝕性,但可腐蝕許多金屬,在有水汽存在的條件下對銅、銀等金屬有腐蝕性,一般若用鐵桶裝氨水,鐵桶應內塗瀝青。
(11)NH3能使濕潤的紫色石蕊試紙變藍。電離方程式在水中產生少量氫氧根離子,呈弱鹼性。
氨的製法
工業製法
工業上氨是以哈伯法通過N2和H2在高溫高壓和催化劑存在下直接化合而製成:
工業上制氨氣
高溫高壓
N2(g)+3H2(g)========2NH3(g)(可逆反應)
催化劑△rHθ=-92.4kJ/mol
工業製備流程
工業制氨絕大部分是在高壓、高溫和催化劑存在下由氮氣和氫氣合成製得。氮氣主要來源於空氣;氫氣主要來源於含氫和一氧化碳的合成氣(純氫也來源於水的電解)。由氮氣和氫氣組成的混合氣即為合成氨原料氣。從燃料化工來的原料氣含有硫化合物和碳的氧化物,它們對於合成氨的催化劑是有毒物質,在氨合成前要經過淨化處理。
1、哈伯法制氨:
高溫高壓
N2(g)+3H2(g)========2NH3(g)(可逆反應)△rHθ=-92.4kJ/mol
催化劑
2、天然氣制氨 :天然氣先經脫硫,然後通過二次轉化,再分別經過一氧化碳變換、二氧化碳脫除等工序,得到的氮氫混合氣,其中尚含有一氧化碳和二氧化碳約0.1%~0.3%(體積),經甲烷化作用除去後,製得氫氮摩爾比為3的純淨氣,經壓縮機壓縮而進入氨合成迴路,製得產品氨。以石腦油為原料的合成氨生產流程與此流程相似。
3、重質油制氨:重質油包括各種深度加工所得的渣油,可用部分氧化法製得合成氨原料氣,生產過程比天然氣蒸汽轉化法簡單,但需要有空氣分離裝置。空氣分離裝置製得的氧用於重質油氣化,氮用於氨合成原料。
4、煤(焦炭)制氨:煤直接氣化(見煤氣化)有常壓固定床間歇氣化、加壓氧-蒸汽連續氣化等多種方法。例如早期的哈伯-博施法合成氨流程,以空氣和蒸汽為氣化劑,在常壓、高溫下與焦炭作用,製得含(CO+H2)/N2摩爾比為3.1~3.2的煤氣,稱為半水煤氣。半水煤氣經洗滌除塵後,去氣櫃,經過一氧化碳變換,並壓縮到一定壓力後,用加壓水洗滌除去二氧化碳,再進一步用壓縮機壓縮後用銅氨液進行洗滌,以除去少量一氧化碳、二氧化碳,然後送去合成氨。
實驗製備
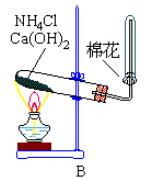 氨氣
氨氣實驗室,氨常用銨鹽與鹼作用或利用氮化物易水解的特性製備:
2NH4Cl+Ca(OH)2===2NH3↑+CaCl2+2H2O↑
Li3N+3H2O===LiOH+NH3↑
銨鹽
 氨氣
氨氣②受熱分解,所有的銨鹽加熱後都能分解,其分解產物與對應的酸以及加熱的溫度有關。分解產物一般為氨和相應的酸。如果酸具有氧化性,則在加熱條件下,氧化性酸和產物氨將進一步反應,使NH3氧化為N2或其氧化物:
碳酸氫銨最易分解,分解溫度為30℃。
硝酸銨受熱分解的產物隨溫度的不同而不同。加熱溫度較低時,分解生成硝酸和氨氣。溫度再高時,產物又有不同;在更高的溫度或撞擊時還會因分解產物都呈氣體而爆炸。氯化銨受熱分解成氨氣和氯化氫。這兩種氣體在冷處相遇又可化合成氯化銨。這不是氯化銨的升華,而是它在不同條件下的兩種化學反應。
硫酸銨要在較高的溫度才分解成NH3和相應的硫酸、磷酸。強熱時,還伴隨有氨被硫酸氧化的副反應,所以產物就比較複雜。
③跟鹼反應放出氨氣
實驗室里就是利用此反應來製取氨,同時也利用這個性質來檢驗銨離子的存在。銨鹽在工農業生產上有重要用途,大量的銨鹽用作氮肥,如NH4HCO3、(NH4)2SO4、NH4NO3等。NH4NO3還是某些炸藥的成分,NH4Cl用於製備乾電池和染料工業,它也用於金屬的焊接上,以除去金屬表面的氧化物薄層。
噴泉實驗
在常溫,常壓下,一體積的水中能溶解700體積的氨。
在乾燥的圓底燒瓶里充滿氨氣,用帶有玻璃管和滴管(滴管里預先吸入水)的塞子塞緊瓶口。立即倒置燒瓶,使玻璃管插入盛水的燒杯里(水裡事先加入少量的酚酞試液),把實驗裝置裝好後。打開橡皮管的夾子,擠壓滴管的膠頭,使少量的水進入燒瓶。觀察現象。
實驗的基本原理是使燒瓶內外在短時間內產生較大的壓強差,利用大氣壓將燒瓶下面燒杯中的液體壓入燒瓶內,在尖嘴導管口形成噴泉。
氨氣檢驗
方法一:
用濕潤的紅色石蕊試紙檢驗,試紙變藍證明有氨氣。
方法二:
用玻璃棒蘸濃鹽酸或者濃硝酸靠近,產生白煙,證明有氨氣。
方法三:
氨氣檢測儀表可以定量測量空氣中氨氣的濃度。
氨氣的危害
臨床表現
吸入的危害表現
氨的刺激性是可靠的有害濃度報警信號。但由於嗅覺疲勞,長期接觸後對低濃度的氨會難以察覺。吸入是接觸的主要途徑,吸入氨氣後的中毒表現主要有以下幾個方面。
輕度吸入氨中毒表現有鼻炎、咽炎、喉痛、發音嘶啞。氨進入氣管、支氣管會引起咳嗽、咯痰、痰內有血。嚴重時可咯血及肺水腫,呼吸困難、咯白色或血性泡沫痰,雙肺布滿大、中水泡音。患者有咽灼痛、咳嗽、咳痰或咯血、胸悶和胸骨後疼痛等。
急性吸入氨中毒的發生多由意外事故如管道破裂、閥門爆裂等造成。急性氨中毒主要表現為呼吸道黏膜刺激和灼傷。其症狀根據氨的濃度、吸入時間以及個人感受性等而輕重不同。
急性輕度中毒:咽乾、咽痛、聲音嘶啞、咳嗽、咳痰,胸悶及輕度頭痛,頭暈、乏力,支氣管炎和支氣管周圍炎。
急性中度中毒:上述症狀加重,呼吸困難,有時痰中帶血絲,輕度發紺,眼結膜充血明顯,喉水腫,肺部有乾濕性噦音。
急性重度中毒:劇咳,咯大量粉紅色泡沫樣痰,氣急、心悸、呼吸困難,喉水腫進一步加重,明顯發紺,或出現急性呼吸窘迫綜合症、較重的氣胸和縱隔氣腫等。
嚴重吸入中毒:可出現喉頭水腫、聲門狹窄以及呼吸道黏膜脫落,可造成氣管阻塞,引起窒息。吸入高濃度的氨可直接影響肺毛細血管通透性而引起肺水腫,可誘發驚厥、抽搐、嗜睡、昏迷等意識障礙。個別病人吸入極濃的氨氣可發生呼吸心跳停止。
皮膚和眼睛接觸的危害表現
低濃度的氨對眼和潮濕的皮膚能迅速產生刺激作用。潮濕的皮膚或眼睛接觸高濃度的氨氣能引起嚴重的化學燒傷。急性輕度中毒:流淚、畏光、視物模糊、眼結膜充血。
皮膚接觸可引起嚴重疼痛和燒傷,並能發生咖啡樣著色。被腐蝕部位呈膠狀並發軟,可發生深度組織破壞。
高濃度蒸氣對眼睛有強刺激性,可引起疼痛和燒傷,導致明顯的炎症並可能發生水腫、上皮組織破壞、角膜混濁和虹膜發炎。輕度病例一般會緩解,嚴重病例可能會長期持續,並發生持續性水腫、疤痕、永久性混濁、眼睛膨出、白內障、眼瞼和眼球粘連及失明等併發症。多次或持續接觸氨會導致結膜炎。
急救措施
清除污染
如果患者只是單純接觸氨氣,並且沒有皮膚和眼的刺激症狀,則不需要清除污染。假如接觸的是液氨,並且衣服已被污染,應將衣服脫下並放入雙層塑膠袋內。
如果眼睛接觸或眼睛有刺激感,套用大量清水或生理鹽水沖洗20min以上。如患者戴有隱形眼鏡,又容易取下並且不會損傷眼睛的話,應取下隱形眼鏡。
對接觸的皮膚和頭髮用大量清水沖洗15min以上。沖洗皮膚和頭髮時要注意保護眼睛 。
病人復甦
應立即將患者轉移出污染區,至空氣新鮮處,對病人進行復甦三步法(氣道、呼吸、循環)。
氣道:保證氣道不被舌頭或異物阻塞。
呼吸:檢查病人是否呼吸,如無呼吸可用袖珍面罩等提供通氣。
循環:檢查脈搏,如沒有脈搏應施行心肺復甦。
初步治療
氨中毒無特效解毒藥,應採用支持治療。
如果接觸濃度≥500ppm,並出現眼刺激、肺水腫的症狀,應立即就醫。
對氨吸入者,應給濕化空氣或氧氣。如有缺氧症狀,應給濕化氧氣。
如果呼吸窘迫,應考慮進行氣管插管。
如皮膚接觸氨,會引起化學燒傷,可按熱燒傷處理:適當補液,給止痛劑,維持體溫,用消毒墊或清潔床單覆蓋傷面。如果皮膚接觸高壓液氨,要注意凍傷。
誤服者給飲牛奶,有腐蝕症狀時忌洗胃 。
泄漏應急處置措施
氨對人體生理的影響氨無色具有強烈的刺激臭味,對人體有較大的毒性。氨氣慢性中毒會引起慢性氣管炎、肺氣腫等呼吸系統病,急性氨中毒反映在咳嗽不止、憋氣等。
(1)少量泄漏。
撤退區域內所有人員。防止吸入蒸氣,防止接觸液體或氣體。處置人員應使用呼吸器。禁止進入氨氣可能匯集的局限空間,並加強通風。只能在保證安全的情況下堵漏。泄漏的容器應轉移到安全地帶,並且僅在確保全全的情況下才能打開閥門泄壓。可用砂土、蛭石等惰性吸收材料收集和吸附泄漏物。收集的泄漏物應放在貼有相應標籤的密閉容器中,以便廢棄處理。
(2)大量泄漏。
疏散場所內所有未防護人員,並向上風向轉移。泄漏處置人員應穿上全封閉重型防化服,佩戴好空氣呼吸器,在做好個人防護措施後,用噴霧水流對泄漏區域進行稀釋。通過水槍的稀釋,使現場的氨氣漸漸散去,利用無火花工具對泄漏點進行封堵。
向當地政府和“119”及當地環保部門、公安交警部門報警,報警內容應包括事故單位;事故發生的時間、地點、化學品名稱和泄漏量、危險程度;有無人員傷亡以及報警人姓名、電話。
禁止接觸或跨越泄漏的液氨,防止泄漏物進入陰溝和排水道,增強通風。場所內禁止吸菸和明火。在保證安全的情況下,要堵漏或翻轉泄漏的容器以避免液氨漏出。要噴霧狀水,以抑制蒸氣或改變蒸氣雲的流向,但禁止用水直接衝擊泄漏的液氨或泄漏源。防止泄漏物進入水體、下水道、地下室或密閉性空間。禁止進入氨氣可能匯集的受限空間。清洗以後,在儲存和再使用前要將所有的保護性服裝和設備清洗消毒。
火災應急處置措施
在貯存及運輸使用過程中,如發生火災應採取以下措施:
(1)報警:迅速向當地119消防、政府報警。報警內容應包括:事故單位;事故發生的時間、地點、化學品名稱、危險程度;有無人員傷亡以及報警人姓名、電話。
(2)隔離、疏散、轉移遇險人員到安全區域,建立500m左右警戒區,並在通往事故現場的主要幹道上實行交通管制,除消防及應急處理人員外,其他人員禁止進入警戒區,並迅速撤離無關人員。
(3)消防人員進入火場前,應穿著防化服,佩戴正壓式呼吸器。氨氣易穿透衣物,且易溶於水,消防人員要注意對人體排汗量大的部位,如生殖器官、腋下、肛門等部位的防護。
(4)小火災時用乾粉或CO2滅火器,大火災時用水幕、霧狀水或常規泡沫。
(5)儲罐水災時,儘可能遠距離滅火或使用遙控水槍或水炮撲救。
(6)切勿直接對泄漏口或安全閥門噴水,防止產生凍結。
(7)安全閥發出聲響或變色時應儘快撤離,切勿在儲罐兩端停留。
職業危害預防措施
(1)氨作業工人應進行作業前體檢,患有嚴重慢性支氣管炎、支氣管擴張、哮喘以及冠心病者不宜從事氨作業。
(2)工作時應選用耐腐蝕的工作服、防鹼手套、眼鏡、膠鞋、防毒口罩,防毒口罩應定期檢查,以防失效。
(3)在使用氨水作業時,應隨身備有清水,以防萬一;在氨水運輸過程中,應隨身備有3%硼酸液,以備急救沖洗;配製一定濃度氨水時,應戴上風鏡;使用氨水時,作業者應在上風處,防止氨氣刺激面部;操作時要嚴禁用手揉擦眼睛,操作後洗淨雙手。
(4)預防皮膚被污染,可選用硼酸油膏。
(5)配備良好的通風排氣設施、合適的防爆、滅火裝置。
(6)工作場所禁止飲食、吸菸、禁止明火、火花。
(7)應急救援時,必須佩帶空氣呼吸器。
(8)發生泄漏時,將泄漏鋼瓶的滲口朝上,防止液態氨溢出。
(9)加強生產過程的密閉化和自動化,防止跑、冒、滴、漏。
(10)使用、運輸和貯存時應注意安全,防止容器破裂和冒氣。
(11)現場安裝氨氣監測儀及時報警發現 。
主要用途
氨用於製造氨水、氮肥(尿素、碳銨等)、複合肥料、硝酸、銨鹽、純鹼等,廣泛套用於化工、輕工、化肥、製藥、合成纖維等領域。含氮無機鹽及有機物中間體、磺胺藥、聚氨酯、聚醯胺纖維和丁腈橡膠等都需直接以氨為原料。此外,液氨常用作製冷劑,氨還可以作為生物燃料來提供能源。