物理性質
氯化氫是無色,熔點-114.2℃,沸點-85℃,空氣中不燃燒,熱穩定,到約1500℃才分解。有窒息性的氣味,對上呼吸道有強刺激,對眼、皮膚、黏膜有腐蝕。密度大於空氣 ,其水溶液為鹽酸,濃鹽酸具有揮發性。
| 摩爾質量 | 36.4606 g/mol |
| 外觀 | 無色吸濕性氣體 |
| 密度 | 1.477 g/L(25℃)(氣) |
| 相對密度(水=1) | 1.19 |
| 相對蒸氣密度(空氣=1) | 1.27 |
| 熔點 | 158.8K(-114.2℃) |
| 沸點 | 187.9K(-85℃) |
| 溶解性(水) | 72g/100mL(20℃)(標準壓強) |
| 飽和蒸氣壓(Pa) | 4225.6(20℃) |
化學性質
氯化氫,腐蝕性的不燃燒氣體,與水不反應但易溶於水,空氣中常以鹽酸煙霧的形式存在。易溶於乙醇和醚,也能溶於其它多種有機物;易溶於水,在25℃和1大氣壓下,1體積水可溶解503體積的氯化氫氣體。乾燥氯化氫的化學性質很不活潑。鹼金屬和鹼土金屬在氯化氫中可燃燒,鈉燃燒時發出亮黃色的火焰:
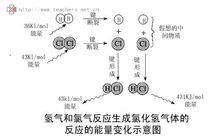 氫氣氯氣反應能量變化圖
氫氣氯氣反應能量變化圖 氯化氫氣體溶於水生成鹽酸,當藥水瓶打開時常與空氣中的小水滴形成鹽酸酸霧。工業用鹽酸常成微黃色,主要是因為三氯化鐵的存在。常用氨水來檢驗鹽酸的存在,氨水會與氯化氫反應生成白色的氯化銨微粒。氯化氫有強烈的偶極,與其它偶極產生氫鍵。
氯化氫的水溶液為鹽酸。
| 與鹽酸能反應的物質 | 活潑金屬 | 金屬氧化物 | 鹼 | 鹽 | 指示劑 | …… |
製取方法
實驗室製取
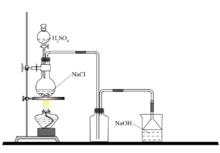 實驗室製取氯化氫
實驗室製取氯化氫 一般是用固體氯化鈉和濃硫酸起反應,不加熱或稍微加熱,分別生成硫酸氫鈉和氯化氫。
NaCl+HSO==NaHSO+HCl↑
然後在500℃到600℃的條件下,繼續起反應而生成氯化氫和硫酸鈉。
NaHSO+NaCl==NaSO+HCl↑
總的化學方程式可以表示如下:
2NaCl+HSO==NaSO+2HCl↑(註:加熱且缺水環境下 HCl才加 ↑)
工業製取
氯鹼工業:
2NaCl+2HO====2NaOH+H↑+Cl↑
H+Cl= =2HCl