流行病學
發生率為8%~10%據臨床調查,無晶狀體眼PVR的發生率為11.1%;再次手術後為19.5%。視網膜裂孔大,發生率較高。如裂孔大小在70°~90°範圍時發生率為23%;90°~180°為50%;大於180°,為73%。
病因
增生性玻璃體視網膜病變常見於過強的冷凝、電凝、外傷後、巨大視網膜裂孔、多發視網膜裂孔、長期孔源性視網膜脫離、多次眼內手術、眼外傷以及眼內炎症等。對發生的危險因素尚不十分肯定。但已知這些因素包括裂孔的大小和性質,玻璃體積血、炎症或手術,以及視網膜冷凝等。裂孔的性質可能是更重要的1個因素。伴有鋸齒緣離斷、圓形萎縮性裂孔、高度近視的黃斑小裂孔往往不發生PVR;邊緣翻卷或固定的馬蹄形裂孔,很容易發生。合併玻璃體積血,有明顯的玻璃體液化伴不完全性玻璃體後脫離,實行過玻璃體手術、術前脈絡膜脫離或行廣泛冷凝術,發生率明顯增加。
發病機制
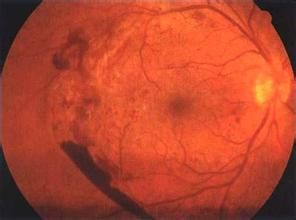
 孔源性視網膜脫離
孔源性視網膜脫離PVR是孔源性視網膜脫離(rhegmatogenous retinal detachment,RRD)的常見併發症,也是造成RRD手術失敗和術後視力恢復不理想的主要原因之一。認為PVR形成過程為組織創傷修復過程,屬於瘢痕形成的範疇。引起黃斑部病變最常見的是在黃斑部發生組織增生性病變形成視網膜前膜,即所謂的黃斑皺褶(macular pucker)。視網膜表面細胞的增生和收縮是黃斑皺褶形成的基本病理過程,大致可分為3個階段:①細胞游離和積聚。當視網膜發生裂孔後,視網膜色素上皮細胞在炎性因子的刺激下游離於玻璃體腔中,在玻璃體纖維或視網膜表面附著、聚集。②細胞增生及形成膜。大量聚集的視網膜色素上皮細胞在某些細胞因子的刺激下繼而開始增生,表型轉化(可轉化為巨噬細胞、成纖維樣細胞),分泌膠原及多種細胞活性物質,加上視網膜神經膠質細胞參與,在玻璃體、視網膜及黃斑表面形成細胞性膜③玻璃體視網膜增殖膜的形成及收縮,牽引視網膜及黃斑(垂直或切線牽引)則形成典型的增殖性玻璃體視網膜病變及牽引性視網膜或黃斑脫離同時,由於某些原因(如長期仰臥位),這些具有增生能力的細胞長期附著,聚集在黃斑區或黃斑下,則會在黃斑區及黃斑下形成緻密的細胞性膜——黃斑前膜及黃斑下膜,由於此膜的存在及收縮,導致黃斑區組織水腫視錐細胞營養不良、變性壞死等一系列改變,視力嚴重下降。
此外,由於眼球穿透傷引起的外傷性增殖性玻璃體視網膜病變會引起外傷性黃斑皺褶,其病理生理過程同樣也是眼組織對創傷的一種過度修復反應。只是因為其產生的原因不同,玻璃體或視網膜黃斑表面聚集的細胞成分及類型略有差別在外傷性黃斑皺褶因常有炎症反應及玻璃體積血的存在,細胞增生則以巨噬細胞、成纖維細胞為主,視網膜色素上皮細胞及神經膠質細胞為輔(指無視網膜裂孔者),因此形成的及黃斑前膜厚而堅韌,對黃斑組織的破壞也更加嚴重。
臨床表現
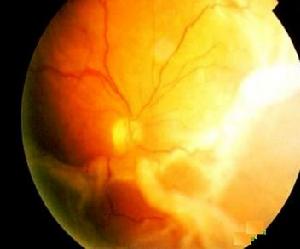
 增生性玻璃體視網膜病變
增生性玻璃體視網膜病變2.在RPE細胞開始增生時,玻璃體混濁增加,並有蛋白性條紋,提示血-眼屏障損害致血漿滲出。
3.視網膜僵硬及皺褶出現,是增生膜形成和收縮牽拉的表現。在裂孔部位,即使看不到膜,裂孔卷邊或蓋膜被拉向玻璃體基部都說明膜的存在。隨著病程進展脫離的視網膜由可活動變為僵硬;增生膜在視網膜前後表面及玻璃體內形成,引起視網膜的不規則皺褶,血管扭曲或伸直,星形皺褶瀰漫性皺褶以及環形收縮形成。
4.視網膜後膜在PVR中常見,據統計可占手術病例的47%,大部分(72%)不影響視網膜復位手術的效果,視力預後尚好;但28%須手術處理在臨床上,視網膜後膜呈多種外觀,如線條狀、樹枝狀、網狀環狀或為管狀條索可為成層、成片的組織可有色素或呈灰黃色。由於這類膜主要由視網膜色素上皮細胞組成,管狀中心包圍著膠原條索,在手術中可被完整取出
5.牽拉性視網膜脫離 當後部視網膜完全皺褶,後玻璃體平面收縮時,就形成典型的漏斗狀脫離。周邊部視網膜冠狀面的前後牽拉使視網膜形成窄漏斗。
以上病程的發展可在任一期穩定,也可能在數月內緩慢發展,但有些病例可在數小時內發展成漏斗狀脫離。在一次手術後,有的觀察指出,視網膜脫離病例確診為PVR的平均時間為4周,但也可長達1年;不過,6個月以上時經過視網膜復位手術的病例發生PVR的機會已很低。
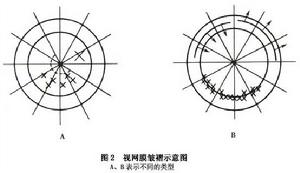
6.1991年的分類法 包括對後部和前部PVR收縮的詳細描述,並分為5型:局限的瀰漫的視網膜下的、環形的以及前部的伴視網膜向前移位。對PVR的程度有更準確地確定不只是分為1~4個象限,而是分成1~12個鐘點。與1983年分類法相比A和B級是一樣的,C和D級合併為C級,C級再分為採用CP(後部)和CA(前部)。原有的D級已不採用。
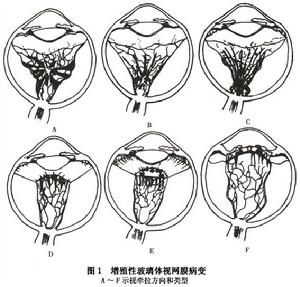
 增生性玻璃體視網膜病變
增生性玻璃體視網膜病變(2)前部PVR:①環形收縮,由赤道部前膜牽拉造成前部視網膜的不規則皺褶,視網膜在圓周方向收縮使後部形成放射形皺褶,而玻璃體基部的視網膜向內牽拉。②前部收縮由沿後玻璃體面的增生膜收縮引起,力的方向與視網膜表面垂直;或在經過玻璃體切除或穿通傷的眼出現,增生膜見於前玻璃體,殘留的後玻璃體或玻璃體基部表面。牽拉主要為前後方向,將脫離的視網膜向前拉,最前部的視網膜形成盆狀。可有異常粘連。與睫狀突粘連可形成低眼壓,與虹膜後粘連可使虹膜向後收縮(圖1,2)。
其它輔助檢查
 增生性玻璃體視網膜病變
增生性玻璃體視網膜病變(1)眼底螢光血管造影:由於視網膜血管被纖維膜牽引,螢光血管造影可見視網膜靜脈迂曲怒張充盈延遲,黃斑周圍小血管迂曲聚攏(圖3)有時可見小的螢光素滲漏點。如黃斑區廣泛滲出、瀰漫性或囊樣水腫,則可見廣泛的螢光素滲漏點有時融合在一起呈花瓣狀有時呈大片狀強螢光區
(2)OCT:在PVR引起的黃斑病變中,OCT檢查有多種不同表現:玻璃體黃斑牽引;不規則的黃斑前膜;黃斑區視網膜神經上皮水腫、增厚、囊變或脫離;有時還可見視網膜色素上皮的微皺褶。
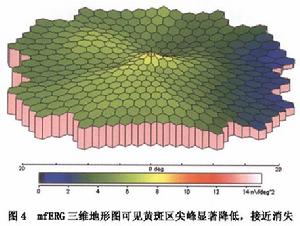
(3)多焦視網膜電圖(mERG):mERG在PVR引起的黃斑病變與其他原因引起的黃斑病變的表現無太多的差別,mERG三維地形圖可見黃斑區尖峰顯著降低或消失(圖4)或在尖峰周圍呈波浪狀外觀;mERG曲線圖可顯示a波、b波振幅也明顯降低(圖5)
2.屈光間質混濁時輔助檢查及黃斑功能評價 在玻璃體重度混濁的情況下準確判斷黃斑區狀況及評價黃斑功能十分困難此時必要的檢查如光感光定位檢查和B超檢查尤為重要B超檢查不但能了解玻璃體纖維膜的分布及活動狀況,且對後極部視網膜及黃斑區的顯示更為清楚。在PVR引起的黃斑病變中,B超檢查可顯示後極部視網膜及黃斑區回聲增強並可發現黃斑牽引條索、黃斑前膜、有無黃斑脫離及了解玻璃體後脫離的情況。
治療
1.手術治療
 增生性玻璃體視網膜病變
增生性玻璃體視網膜病變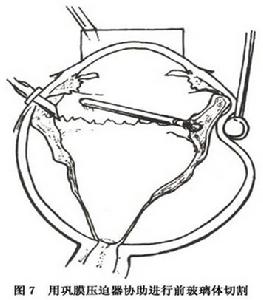 增生性玻璃體視網膜病變
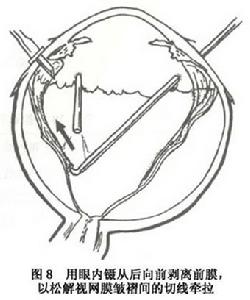
增生性玻璃體視網膜病變(3)一些技術要點:①放射形外墊壓可有效地封閉視網膜裂孔,套用褥式縫線(比矽膠海綿墊寬3mm) 固定,效果可靠。②對只用鞏膜外墊壓不能封閉裂孔或牽拉性脫離起主要作用,需作玻璃體切割術首先切割中央部的玻璃體或無晶狀體眼的前玻璃體層,然後是周邊部在沒有松解後部牽拉前,由於後部的張力存在切除周邊部玻璃體較容易,此時由助手頂壓鞏膜,逐一暴露各個象限進行切除(圖7)對玻璃體基底部常有的緻密纖維組織,可用眼內剪下斷再用切割頭把剩下的玻璃體切除。此後,從後向前分離視網膜前膜,由於後部視網膜較厚,不易造成醫源性裂孔,再以眼內鑷從後向前剝離前膜以松解視網膜皺褶間的切線牽拉(圖8)厚而寬的膜一般容易剝除,如不能整片去掉,可把膜剪碎取出。只對阻止復位的視網膜後膜作切除術。術中先在後膜部位作視網膜切開,此時後膜會自動退縮,如不退縮可用鑷子抓著取出。③採用眼內氣體填塞:可借氣體的表面張力頂壓視網膜裂孔常用的氣體有六氟化硫及全氟丙烷氣液交換前要松解所有的牽拉否則殘留的牽拉會形成新的裂孔,或使原有的裂孔擴大。有時需要先紮緊外墊壓,再作氣液交換。
 增生性玻璃體視網膜病變
增生性玻璃體視網膜病變糖皮質激素類是一種有希望治療PVR的藥物大劑量時能抑制有絲分裂而且對眼的組織無明顯毒性。將緩慢溶解的糖皮質激素注入玻璃體可提供長效的治療劑量,而沒有全身的副作用。已試用酒精地塞米松及醋酸曲安奈德 (後者為結晶狀體)以較大劑量(1~2mg)注入玻璃體,可長期存在(在正常兔眼7周,玻璃體切割術後的眼2周),對成纖維細胞有明顯的抑制作用發生於實驗性視網膜脫離的眼明顯減少,電生理和超微結構檢查未發現毒性反應。由於糖皮質激素也具有強大的抗炎作用,而炎症反應的細胞和體液因子在細胞的遊走和增生中起重要作用,因此糖皮質激素治療PVR的作用也可能部分地通過抗炎而實現,早期全身或局部套用可能有預防作用。
預後
出現牽拉性視網膜脫離時視力預後不良如果牽涉致黃斑區則預後較差。視力預後的好壞在很大程度上取決於手術時機的把握。