基本內容
基本概念
 電解池
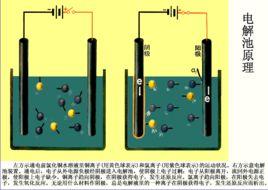
電解池(1)使電流通過電解質溶液或熔融的電解質而在陰、陽兩極上引起還原氧化反應的過程叫做電解。
(2)把電能轉變為化學能的裝置叫做電解池或電解槽。
(3)當離子到達電極時,失去或獲得電子,發生氧化還原反應的過程電解原理(電解池裝置如圖)
陰極:與電源負極相連的電極。(得電子發生還原反應)
陽極:與電源正極相連的電極。(失電子發生氧化反應)
電解定義
電解是使電流通過電解質溶液(或者是熔融的電解質)
而在陰、陽兩極引起還原氧化反應的過程。
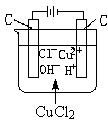
上圖是電解CuCl溶液的裝置。
通電後發生反應:
CuCl=(電解)Cu+Cl
陽極:2Clˉ―2e →Cl
陰極:Cu +2e →Cu↓
電解過程中的能量轉化(裝置特點)一定不參與反應 不一定是惰性電極陽極:不一定參與反應 也不一定是惰性電極
反應條件
①連線直流電源
②陰陽電極 陰極:與電源負極相連為陰極
陽極:與電源正極相連為陽極
③兩極處於電解質溶液或熔融電解質中
④兩電極形成閉合迴路
電極反應
電極反應與電源的正極相連的電極稱為陽極。
物質在陽極上失去電子,發生氧化反應。如上圖裝置中,Cl 在陽極上失去電子轉化為Cl,陽極反應式:2Cl -2e =Cl↑簡記為陽氧。
與電源的負極相連的電極成為陰極。
物質在陰極上得到電子,發生還原反應。如上圖裝置中,Cu 在陰極是得到電子轉化為Cu,陰極反應式:Cu +2e →Cu簡記為陰原(陰原)
電解結果
在兩極上有新物質生成
反應規律
陽極:活潑金屬—電極失電子(Au,Pt除外);
惰性電極—溶液中陰離子失電子
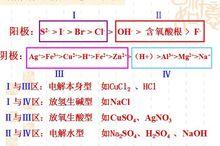
失電子能力:活潑金屬(除Pt,Au)>S >I >Br >Cl >OH >含氧酸根(NO >SO )>F
陰極:溶液中陽離子得電子能力:Ag >Hg >Fe >Cu >H (酸)>Pb >Sn >Fe >Zn >H (水)>Al >Mg >Na >Ca >K (即金屬活潑性順序表的逆向)
規律:鋁前(含鋁)離子不放電,氫(酸)後離子先放電,氫(酸)前鋁後的離子看條件。
四類電解型的電解規律(當陽極為惰性電極時)
①電解水型(強鹼,含氧酸,活潑金屬的含氧酸鹽),pH由溶液的酸鹼性決定,溶液呈鹼性則pH增大,溶液呈酸性則pH減小,溶液呈中性則pH不變。電解質溶液復原—加適量水。
②電解電解質型(無氧酸,不活潑金屬的無氧酸鹽),無氧酸pH變大,不活潑金屬的無氧酸鹽pH不變。電解質溶液復原—加適量電解質。
③放氫生鹼型(活潑金屬的無氧酸鹽),pH變大。電解質溶液復原—加陰離子相同的酸。
④放氧生酸型(不活潑金屬的含氧酸鹽),pH變小。電解質溶液復原—加陽離子相同的鹼或氧化物。
電解意義
使在通常情況下不發生變化的物質發生氧化還原反應,得到所需的化工產品、進行電鍍以及冶煉活潑的金屬,在金屬的保護方面也有一定的用處。
電解工業
氯鹼工業
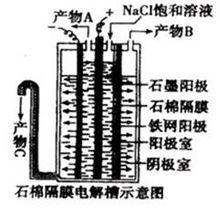 電解池
電解池氯鹼工業(電解飽和食鹽水)製取氯氣、氫氣、燒鹼。
飽和食鹽水溶液中存在Na+和Cl-以及水電離產生的H+和OH-。
其中氧化性H+>Na+,還原性Cl->OH-。所以H+和Cl-先放電(即發生還原或氧化反應)。
陰極:2H++2e-=H2↑(還原反應)
陽極:2Cl--2e-=Cl2↑(氧化反應)
總反應的化學方程式:2NaCl+2H2O=(等號上為通電)2NaOH+H2↑+Cl2↑
用離子方程式表示:2Cl-+2H2O=(等號上為通電)2OH-+H2↑+Cl2↑。
電鍍套用
電鍍:套用電解原理在某些金屬表面鍍上一薄層其他金屬或者合金的過程
條件:①鍍件做陰極②鍍層金屬做陽極③電鍍液中含鍍層金屬離子
電鍍時,把待鍍的金屬製品(即鍍件)作陰極,鍍層金屬作陽極,用含有鍍層金屬離子的溶液作電鍍液。
陽極:Mn-e-=Mn+
陰極:Mn++e-=Mn
這樣,在直流電的作用下,鍍層金屬就均勻地覆蓋到鍍件的表面。同樣的道理,用純銅作陰極,用粗銅作陽極,用CuSO4溶液作電解液。通入直流電,作為陽極的粗銅逐漸溶解,在陰極上析出純銅,從而達到提純銅的目的。
金屬防護
⑴改變金屬的內部組織結構合金鋼中含有合金元素,使組織結構發生變化,耐腐蝕。如:不鏽鋼。
⑵在金屬表面覆蓋保護層。常見方式有:塗油脂、油漆或覆蓋搪瓷、塑膠等;使表面生成緻密氧化膜;在表面鍍一層有自我保護作用的另一種金屬。
⑶電化學保護法
①外加電源的陰極保護法:接上外加直流電源構成電解池,被保護的金屬作陰極。
②犧牲陽極的陰極保護法:外加負極材料,構成原電池,被保護的金屬作正極。
冶鍊金屬
鈉、鈣、鎂、鋁等活潑金屬,很難用還原劑從它們的化合物中還原得到單質,因此必須通過電解熔融的化合物的方法得到。如電解熔融的氯化鈉可以得到金屬鈉:
陰極:2Na++2e-=2Na
陽極:2Cl――2e-=Cl2↑
放電順序
(1)陽極:與電源的正極相連。
當陽極的電極材料為金屬(Pt或Au除外)時,通電後作電極的金屬失去電子變成金屬離子,溶解到電解質溶液中。
當陽極的電極材料是惰性物質(如Au、Pt或石墨)時,通電後溶液中的陰離子在陽極上失去電子,當溶液中同時存在多種陰離子時, 還原性強的離子先失去電子發生氧化反應。
常見陰離子的還原性由強到弱的順序是:活性電極>S2->I->Br->Cl->OH->含氧酸根離子(如SO42-、NO3-等)>F-。
Cl-和OH-在電解時的電極反應式分別是:2Cl-―2e-=Cl2↑
4OH-―4e-=2H2O+O2↑
 如圖
如圖因為水電離能夠產生OH-,所以電解含氧酸鹽溶液時,在陽極上是OH-放電生成氧氣,而含氧酸根離子不發生變化。(當陽極為惰性金屬常用的為C、鉑、金時,自身放電)
(2)陰極:與電源的負極相連。在陰極上發生還原反應的是溶液中的陽離子。
當溶液中存在多種陽離子時,按金屬活動性順序,越不活潑的金屬,其陽離子的氧化性越強,越容易被還原。在水溶液中,鋁之前的金屬的陽離子不可能被還原。
電解規律
注意事項
無氧酸是其本身的電解
含氧酸是水的電解
可溶性鹼是水的電解
活潑性金屬的含氧酸鹽也是水的電解
活潑金屬的無氧鹽陰極析出氫氣並伴隨溶液顯鹼性,陽極析出非金屬單質
不活潑金屬的無氧鹽是該鹽的電解
中等活動性金屬的含氧酸鹽陰極析出金屬,陽極得到氧氣同時酸性提高
1.無氧酸是其本身的電解
2.含氧酸是水的電解
3.可溶性鹼是水的電解
4.活潑性金屬的含氧酸鹽也是水的電解
5.活潑金屬的無氧鹽陰極析出氫氣並伴隨溶液顯鹼性,陽極析出非金屬單質
6.不活潑金屬的無氧鹽是該鹽的電解
7.中等活動性金屬的含氧酸鹽陰極析出金屬,陽極得到氧氣同時酸性提高
記憶方法
陽極出氧鹵,陰極氫金屬。
鹽的離子都放電,離子濃度急速減;
鹽的離子不放電,水耗離子濃度添。
酸根離子單放電,產物必得鹵氫鹼;
金屬離子單放電,產物必得含氧酸。