雙氮配合物
正文
配體中至少有一個氮分子與金屬結合的配位化合物。分子氮作為配體時稱為雙氮。在常溫下氮是一種惰性氣體,因此曾認為氮分子內的三重鍵(N呏N)非常牢固。1965年首次合成的釕的分子氮配合物,引起了舉世的矚目。現在合成的雙氮配合物已有數百種之多。元素周期表(見彩圖) 中自第ⅣB族起的過渡元素,絕大多數皆已用常規方法製得了各種不同的雙氮配合物,只有釩、鎝、鉿、鉭等少數元素還未形成穩定的雙氮配合物。第Ⅷ族過渡金屬有與N2形成配合物的突出能力,其中過渡金屬以低的氧化態存在,如Co(I)或Ni(0)。
中自第ⅣB族起的過渡元素,絕大多數皆已用常規方法製得了各種不同的雙氮配合物,只有釩、鎝、鉿、鉭等少數元素還未形成穩定的雙氮配合物。第Ⅷ族過渡金屬有與N2形成配合物的突出能力,其中過渡金屬以低的氧化態存在,如Co(I)或Ni(0)。 雙氮配體的配位本質 鈷配合物 【Co(Ph3P)3N2H】(Ph為苯基)的X射線晶體結構測定表明,Co-N-N鍵是線形的,電子密度從金屬流向N2的空分子軌道。N-N鍵長1.10埃,比自由N2的鍵長1.098埃稍長,表明N呏N三重鍵的削弱。在大多數雙氮配合物中,氮分子是以頂端配位在金屬中心原子上的,但也發現有側配位的。例如附圖所示的雙氮側配位化合物,它是由四苯基雙鎳分子組成,Ni-Ni之間有單鍵。N2側配位於兩個Ni原子,每個 N又以頂端配位於Li-Li鍵的中心。這種配位作用使N-N鍵長由1.098埃伸長到1.36埃,即介於雙鍵與單鍵之間,雙氮內鍵的強度大大削弱,故很容易氫化而產生氨。N2結合在金屬表面上有兩種類型的配位,一種是端配位,另一種是N呏N分子平臥於表面,即側配位。
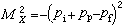
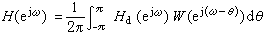
製法 1965年合成的釕配合物【Ru(NH3)5N2】2+是用水合肼還原RuCl3而製得。以後發現也可先形成【Ru(NH3)5N3】2+,然後慢慢地分解,形成雙氮配合物。雙氮配合物也可直接由N2合成:
【Ru(NH3)5H2O】2++N2─→【Ru(NH3)5N2】2++H2O
N2取代H2O,顯示出N2的活性。這種性質也在下列橋式配合物的合成反應中表現出來:【Ru(NH3)5N2】2++【Ru(NH3)5H2O】2+─→
【(NH3)5RuN2Ru(NH3)5】4++H2O
目前主要研究合成新的雙氮配合物,將配位的雙氮還原為氨,以及將反應後配合物再生等方面。
參考書目
E. Huheey, Inorganic Chemistry, Principles of Structure and Reactivity, 3rd ed., Harper & International Science,Cambridge,1983.
