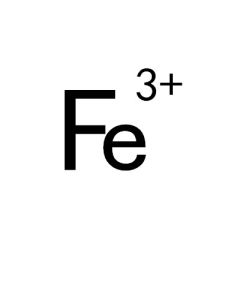介紹
鐵是一變價元素,常見價態為+2和+3。鐵與硫、硫酸銅溶液、鹽酸、稀硫酸等反應時失去兩個電子,成為+2價。與Cl2、Br2、硝酸及熱濃硫酸反應,則被氧化成Fe3+。鐵與氧氣或水蒸氣反應生成的Fe3O4,往往被看成FeO·Fe2O3或Fe(FeO2)2,但實際上是一種具有反式尖晶石結構的晶體,既不是混合物,也不是鹽。其中有1/3的Fe為+2價,另2/3為+3價。鐵的+3價化合物較為穩定。化學性質
 鐵離子與硫氰酸鉀
鐵離子與硫氰酸鉀鐵離子的氧化性是大於銅離子的,而鐵單質可以還原銅離子,自然更能還原鐵離子了。還原性從大到小:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、H、Cu、Hg、Ag、Pt、Au。
氧化性從小到大:K+、Ca2+、Na+、Mg2+、Al3+、Zn2+、Fe2+、Sn4+、Pb2+、H+、Cu2+、Fe3+、Hg+、Ag+,其實這是按照金屬活動性順序排列的。(註:Pt、Au 很穩定,一般很難形成對應的離子)
氯、氮等與其形成配合物時,溶液顯黃色。而真正的六水合鐵離子為淺紫色。
另外,鐵在置換反應中為+2價。
物理性質
含Fe3+的溶液-----不一定,形成不同的配合物[Fe(H2O)6]3+為淡紫色,而[FeCln]3-n(n=1~4)為黃色**註:中學一般認為三價鐵離子是黃色的,實際是錯誤的,嚴格來說最正確的解釋應該是六水合物的淡紫色,而其黃色來自於[Fe(H2O)6]3+水解後生成的[Fe(H2O)n(OH)6-n]3-n,溶液酸性較強時(pH<0),Fe3+主要以淡紫色的[Fe(H2O)6]3+存在。如果使pH提高到2~3,水解趨勢就很明顯氫氧化鐵是紅褐色沉澱。
檢驗方法
二價鐵離子亦稱亞鐵離子(Fe2+)檢驗:(1)加K3[Fe(CN)6]( 鐵氰化鉀,黃色)溶液,生成帶有特徵藍色的鐵氰化亞鐵沉澱(滕士藍):
3Fe2+ + 2[Fe(CN)6]3- =Fe3[Fe(CN)6]2↓
(2)加SCN-(離子),不顯血紅色,通入氯氣後,顯血紅色。
(3)加入NaOH(aq),產生白色絮狀沉澱Fe(OH)2,其在空氣中迅速變為灰綠色,最終成為紅褐色沉澱Fe(OH)3.(方程式:4Fe(OH)2+O2+2H2O = 4Fe(OH)3) 三價鐵離子(Fe3+)的檢驗方法:
(1)加 苯酚顯紫紅色(絡合物)
(2)加SCN-(離子) 顯血紅色 (絡合物)
(3)加氫氧化鈉有紅褐色沉澱,從開始沉澱到沉澱完全時溶液的pH(常溫下):2.7~3.7
鑑別方法
Fe2+ 亞鐵離子一般呈淺綠色,有較強的還原性,能與許多氧化劑反應,如氯氣,氧氣等。因此亞鐵離子溶液最好現配現用,儲存時向其中加入一些鐵粉(三價鐵離子有強氧化性,可以與鐵單質反應生成亞鐵離子) 亞鐵離子也有氧化性,但是氧化性比較弱,能與鎂、鋁、鋅等金屬發生置換反應。檢驗方法:
方法1:觀察。亞鐵離子,是綠色的,看的出來。
方法2:加入 硫氰化鉀(不是硫氫化鉀),不顯血紅色.然後加入氯水,顯血紅色,則為亞鐵離子
 硫化鈉溶液與鐵離子反應原理用來處理污水
硫化鈉溶液與鐵離子反應原理用來處理污水反應離子方程式:
2Fe2+ +Cl2 ==2Fe3+ +2Cl-
Fe3+ +3SCN- ==Fe(SCN)3(絡合反應,是可逆的,是檢驗三價鐵的特徵反應;二價鐵無此特性)
方法3:加入 氫氧化鈉溶液,生成白色沉澱,白色沉澱迅速變成灰綠色,最後,變成紅褐色。這證明有鐵離子。
方法4:向溶液中加入酸性 高錳酸鉀,若褪色,則有二價鐵,不褪色,則完全變質。
方法5:向溶液中加入 醋酸鈉,由於二價鐵遇 醋酸鈉無現象,而三價鐵則發生 雙水解,產生沉澱,再結合。
方法6:向兩種溶液中分別加入用 硫酸酸化的 溴水,振盪,能使溴水褪色的是二價鐵的溶液,不能使溴水 褪色的是三價鐵溶液。
離子方程式:2Fe2+ +Br2 = 2Fe3+ + 2Br-
方法7:向兩種溶液中加入 苯酚,變紫色的是三價鐵的溶液(苯酚與三價鐵生成紫色的絡離子),不變紫色的是二價鐵的溶液。
離子反應方程式:
Fe3+ + 6C6H5OH =[Fe(C6H5O)6]3- + 6H+。
方法8:在 澱粉碘化鉀試紙上分別滴兩種溶液,變藍的是三價鐵的溶液(碘化鉀與三價鐵生成碘單質使澱粉變藍),不變藍的是二價鐵溶液。
相關反應
鐵與非氧化性酸反應生成亞鐵離子 Fe +2HCl == FeCl2 + H2↑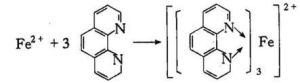 鄰菲羅啉反應
鄰菲羅啉反應亞鐵離子轉化成鐵單質 Fe2+ + Zn == Fe + Zn2+
鐵在氯氣中燃燒生成三價鐵離子 2Fe +3Cl2 === 2FeCl3
三價鐵轉化為鐵單質Fe2O3+3CO=2Fe+3CO2
鐵離子轉化成亞鐵離子 2Fe3+ + Fe ===3 Fe2+
亞鐵離子轉化成鐵離子 2Fe2+ + Cl2 === 2Fe3+ +2Cl-
其他
1.可溶性硫氰化物法(這是高中化學最常用的方法)
用2支試管分取兩種溶液各少量,分別滴入可溶性硫氰化物(如KSCN、NaSCN、NH4SCN)等溶液,變血紅色的是三價鐵溶液:
不變血紅色的是二價鐵溶液,因為Fe與SCN生成的絡合物Fe(SCN)2為無色
2.加鹼法
取三價鐵與二價鐵溶液分別加入鹼液(如氨水、氫氧化鈉、氫氧化鉀溶液),生成紅褐色沉澱的是三價鐵溶液。
(加氨水)Fe3++3NH3·H2O<===>Fe(OH)3↓+3NH4+,現象紅褐
(加強鹼)Fe2++2OH-===Fe(OH)2↓,
現象:[span]生成白色沉澱並立即轉變為綠色,最後變為紅褐色的是二價鐵溶液,
(加氨水)Fe2++2NH3·H2O=Fe(OH)2↓+2NH4+,現象白至綠
(加強鹼)Fe2++2OH-=Fe(OH)2↓,現象白至綠
4Fe(OH)2+2H2O+O2=4Fe(OH)3↓,現象紅褐
3.苯酚法
在盛苯酚溶液的2支試管中分別滴入幾滴三價鐵與二價鐵溶液,變紫色的是三價鐵的溶液(苯酚與Fe3+生成紫色的絡離子),不變紫色的是二價鐵的溶液。
Fe3++6C6H5OH=[Fe(C6H5O)6]-+6H+
4.赤血鹽法
 鐵離子
鐵離子取三價鐵和二價鐵溶液分別滴入赤血鹽溶液,出現滕氏藍沉澱的是二價鐵溶液,無滕氏藍沉澱生成的是三價鐵溶液,
3Fe+2[Fe(CN)6]=Fe3[Fe(CN)6]2↓,滕氏藍
5.黃血鹽法
取三價鐵和二價鐵溶液,分別滴入黃血鹽溶液,出現普魯士藍沉澱的是三價鐵的溶液,無普魯士藍沉澱生成的是二價鐵的溶液。
4Fe+3Fe(CN)6=Fe4[Fe(CN)6]3↓,普魯士藍
取二溶液分別滴入純鹼溶液,產生灰色沉澱的是含Fe2+的溶液。Fe2++CO32-=FeCO3↓(灰色)
生成紅褐色沉澱的是Fe3+的溶液:
2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑紅褐
7.銅片法
在銅片的兩個位置上分別滴上二溶液,過一段時間後銅片腐蝕的是Fe3+的溶液,無明顯現象的是Fe2+的溶液。
2Fe3++Cu=2Fe2++Cu2+
8.碘化鉀澱粉試紙法
分別將碘化鉀澱粉試紙浸入兩種溶液中,使試紙變藍的是Fe3+的溶液:2Fe3++2I-=2Fe2++I2
不能使試紙變藍的是Fe2+的溶液。
9.高錳酸鉀法
分取二溶液分別加入酸性高錳酸鉀溶液中,振盪,高錳酸鉀溶液的紫色褪去的是Fe2+的溶液。
10Fe2++2MnO4-+16H+=10Fe3++2Mn2++8H2O
不能使酸性高錳酸鉀溶液褪色的是Fe3+的溶液。
10.雙氧水法
取二溶液,分別滴入雙氧水和氰化鉀溶液,產生紅褐色沉澱的是Fe2+的溶液
6FeSO4+12KCN+3H2O2=4Fe(CN)3+2Fe(OH)3↓+6K2SO4紅褐
11.鉻酸鉀法
分取二溶液,分別加入鉻酸鉀和硫酸的混合液,有深綠色沉澱生成的是Fe2+的溶液:
6Fe2++2CrO42-+10H+=Cr2O3↓+6Fe3++5H2O深綠
無深綠色沉澱生成的是Fe3+的溶液。
12.溴水法
在分別盛有用硫酸酸化的溴水的2支試管中,分別滴入二溶液,振盪,能使溴水褪色的是Fe2+的溶液:2Fe2++Br2=2Fe3++2Br-
不能使溴水褪色的是Fe3+溶液。
相關反應
鐵與非氧化性酸反應生成亞鐵離子Fe+2HCl==FeCl2+H2↑
亞鐵離子轉化成鐵單質Fe2++Zn==Fe+Zn2+
鐵在氯氣中燃燒生成三價鐵離子2Fe+3Cl2===2FeCl3
三價鐵轉化為鐵單質Fe2O3+3CO=2Fe+3CO2
鐵離子轉化成亞鐵離子2Fe3++Fe===3Fe2+
亞鐵離子轉化成鐵離子2Fe2++Cl2===2Fe3++2Cl-