正文
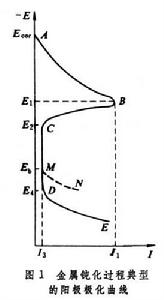
金屬鈍化的特徵曲線 圖1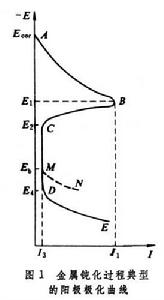 為金屬鈍化過程的陽極極化曲線(採用控制電極電勢方法測定)。整個曲線分四個區:
為金屬鈍化過程的陽極極化曲線(採用控制電極電勢方法測定)。整個曲線分四個區: 活性溶解區 見曲線AB部分,金屬按正常的規律發生陽極溶解。
鈍化過渡區 見曲線BC部分,當電極電勢到達某一臨界值E1時,金屬的表面狀態發生突變,開始生成一層保護膜,隨著電極電勢正移,電流卻急劇下降,金屬的陽極過程按另一種規律進行,金屬開始鈍化。相應於B點的電勢 E1和電流密度I1分別稱為致鈍電勢和致鈍電流密度。C點相應於已能覆蓋金屬表面的保護膜的生長基本結束點,C點電勢 E2稱為穩定鈍化電勢或完全鈍化電勢。金屬鈍化研究中流行的弗萊德電勢(通過陽極極化使金屬鈍化後,中斷極化電流,在電勢-時間衰退曲線上所出現的平階電勢),有人提出它是E1,多數人認為是E2。
穩定鈍化區 見曲線的CD部分,金屬以I3(即維持鈍態的電流密度)的速率溶解。I3基本上與電極電勢無關。這時金屬表面可能生成一層耐蝕性好的氧化物。
過鈍化區 見曲線的DE部分,電流再次隨電極電勢的正移而增加。這可能由於氧化膜被進一步氧化生成更高價的可溶性氧化物,或某種新的陽極反應開始發生(例如氫氧離子在陽極放電,並放出氧氣)。相應於D點的電勢E4稱為過鈍化(或超鈍化)電勢。
鈍化機理 長期以來,關於鈍化機理一直沒有統一的認識。爭議的焦點在於引起鈍化的膜到底是準二維的,還是三維的。前者常稱為吸附理論,後者稱為成相膜理論,近年來這兩種理論漸趨合一。
吸附理論 只要在金屬表面或部分表面上有氧或含氧粒子(氧原子或OH-、O2-離子)的吸附層,就能引起金屬鈍化,這一吸附層至多只有單分子層厚,吸附層改變了金屬-溶液界面結構,大大提高陽極反應的活化能,降低金屬陽極溶解的速率;另一方面界面電場卻促進陽極反應的活化作用,這兩個相對立的作用基本上相互抵消,使鈍態金屬的溶解速率基本上與電極電勢無關。但在過鈍化區,如果電極電勢達到可能生成可溶性的高價含氧離子,則氧的吸附反而能促使高價離子的形成,主要是後一種因素起作用,因此金屬陽極溶解速率再次增大。鉻鈍化的實驗事實可以利用吸附理論較好地加以解釋。
成相膜理論 當金屬電勢增高時,可在表面上生成緻密的、覆蓋性良好的成相鈍化膜,它把金屬和溶液機械地隔開,使金屬的溶解速率大大地降低,金屬轉為鈍態。在鈍化區,金屬溶解的速率決定於膜的化學溶解速率,它與電極電勢無關。相當多的金屬鈍化現象(如碳鋼在濃硝酸溶液中的鈍化)可用成相膜加以解釋。近年來,有人提出由於吸咐在金屬表面上的含氧粒子參加電化學反應而直接形成“第一層氧層”後,金屬的溶解速率已大幅度下降,然後在這種氧層基礎上繼續生長形成成相的氧化物層,它使金屬穩固地鈍化。這個將金屬鈍化的兩種理論統一起來的嘗試,有待進一步的實驗證實。
鈍化膜 大多數的鈍化膜是由金屬氧化物所組成的,例如穩固的鐵的鈍化膜可能為γFe2O3、Fe3O4;鋁的鈍化膜為無孔的γAl2O3上面再覆蓋以多孔的βAl2O3。在一定條件下,鉻酸鹽、磷酸鹽、矽酸鹽和難溶的硫酸鹽以及氯化物也可以參與構成鈍化膜。鈍化膜的厚度一般在幾十埃到幾百埃。表面成分分析的實驗發現,鈍化膜在有保護金屬能力時,其成分也常出現非整比化合物的情況。鈍化膜有的具有晶體結構,有的則是非晶結構(玻璃體結構),具有晶體結構的鈍化膜,有的與金屬基體有外延關係。實驗上發現,隨著鉻含量的增加,鐵鉻合金上鈍化膜的結構由尖晶石結構逐漸變成非晶結構,因此這種非晶結構的鈍化膜(例如不鏽鋼的鈍化膜)可視為無機聚合物大分子。鈍化膜的導電性質通常介於半導體和絕緣體之間。具有非晶結構的鈍化膜的機械性能優於具有晶體結構的鈍化膜。因為鈍化膜是與介質相鄰的金屬表面上的一層薄膜,對其研究難度較大,因此有關鈍化膜的成分、結構和電性質等,經常出現有爭議的實驗結果和結論。
鈍性的破壞 耐蝕純金屬和合金大量依靠鈍化起耐蝕作用,金屬鈍性的破壞是它們發生局部腐蝕的最主要原因。過鈍化將破壞金屬的鈍性,這在上面已提到。但更常遇到的是介質中含有侵蝕性陰離子(如氯離子等)所引起的鈍性破壞。在含侵蝕性陰離子介質中金屬的陽極極化曲線將如圖1中的ABCM N,在比過鈍化電勢E4為負的電勢Eb下,金屬陽極溶解電流便開始顯著增大,Eb稱為擊穿電勢(或破裂電勢)。如圖2
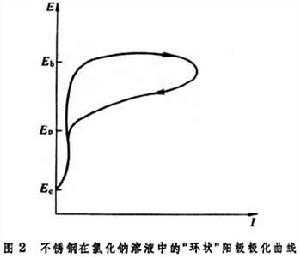 用電化學循環伏安法研究鈍態金屬表明,除了出現特徵電勢Eb外,伏安曲線出現一個環,環閉合點電勢為另一特徵電勢Ep,它相應於鈍性重新恢復的電勢,稱為保護電勢。一般認為,若金屬的電極電勢E<Ep,則金屬處於鈍態;若Ep<E<Eb,則金屬表面上已腐蝕的小孔將繼續生長,但不形成新的蝕孔;若E>Eb,則金屬表面有大量蝕孔產生。Eb和(Eb-Ep)已被用為評價金屬耐局部腐蝕傾向的指標。將含氯離子介質中測定的Ep、Eb和Ec對相應的pH值作圖、在pH-電勢圖上,得到可同時判斷腐蝕和局部腐蝕傾向的實驗電勢-pH腐蝕圖。
用電化學循環伏安法研究鈍態金屬表明,除了出現特徵電勢Eb外,伏安曲線出現一個環,環閉合點電勢為另一特徵電勢Ep,它相應於鈍性重新恢復的電勢,稱為保護電勢。一般認為,若金屬的電極電勢E<Ep,則金屬處於鈍態;若Ep<E<Eb,則金屬表面上已腐蝕的小孔將繼續生長,但不形成新的蝕孔;若E>Eb,則金屬表面有大量蝕孔產生。Eb和(Eb-Ep)已被用為評價金屬耐局部腐蝕傾向的指標。將含氯離子介質中測定的Ep、Eb和Ec對相應的pH值作圖、在pH-電勢圖上,得到可同時判斷腐蝕和局部腐蝕傾向的實驗電勢-pH腐蝕圖。 有關金屬鈍化和鈍性破壞的研究,引導人們去研製新的合金和緩蝕劑,以獲得耐破壞的鈍化膜,這種鈍化膜應當具有侵蝕性陰離子難以擴散的結構、耐機械破壞的延性、低的溶解度、低的電子導電性及良好的再鈍化能力。研製具有能促使形成非晶鈍化膜的成分和結構的合金,是獲得耐破壞鈍化膜的重要方向。
參考書目
南京化工學院等合編,魏寶明主編:《金屬腐蝕理論及套用》,化學工業出版社,北京,1984。