概述
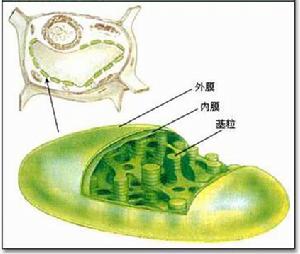 葉綠體具有雙層膜結構、有自己的遺傳物質
葉綠體具有雙層膜結構、有自己的遺傳物質葉綠體是植物進行光合作用和能量轉化的重要細胞器。電子顯微鏡研究表明,高等植物葉肉細胞與藻類(如小球藻)的葉綠體是一個具有雙層膜的片層系統。除去整個葉綠體被雙層外膜所包圍並與細胞質分離開以外,葉綠體中緊緊壓在一起的由許多小片層組成的小體,稱為基粒,構成基粒的片層稱為基粒片層,又稱小類囊體;而圍繞在基粒周圍的某種顆粒狀電子密集較淺的介質稱為基質,其中單個與基粒相連的片層稱為基質片層,又稱大類囊體。整個類囊體均由雙層膜構成。基粒中含有定向排列的葉綠素分子,包括葉綠素a與b;基質中則含有大量的酶。
此外,在小球藻的葉綠體中含有造粉體。它的作用不清楚。由於澱粉粒常常存在於造粉體的周圍,故構想它可能與澱粉的形成有關。
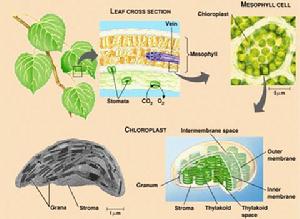 葉綠體
葉綠體高等植物中有關葉綠體功能的研究表明,光反應以及有關的光合作用電子傳遞反應是在基粒片層中進行的,而CO2的固定或光合作用的暗反應則發生在基質區域。離體的菠菜葉綠體經超音波破壞並高速離心後,含有葉綠素的片層沉澱,而無色的基質部分則懸浮於上清液中。片層沉澱能夠進行希爾反應及光合磷酸化反應;無色的基質上清液部分含有95%以上的光合作用CO2固定酶——雙磷酸核酮糖羧化酶(RuBPC酶)。進一步利用14C標記分析表明,單獨用基質部分所固定的14CO2,僅產生微量的磷酸甘油酸——光合作用第一個碳產物;當把片層部分單獨同14CO2溫育時,也有少量磷酸甘油酸及還原產物發生。但是,如果把基質和基粒片層兩部分混合在一起時,則14CO2的固定增加60倍。這個實驗清楚地說明,基粒與基質的光合功能是密切聯繫而不可分割的。
在遺傳學的歷史發展中,長時期以來積累了大量的資料,充分肯定了一個問題:即核或染色體的遺傳作用。但是,對於核以外其它細胞器的遺傳作用,卻一直沒有給予重視,甚至形成一種假象,似乎核以外細胞器的遺傳是無足輕重的。這大大地阻礙了細胞遺傳學的發展。
其實,早在1909年,也就是孟德爾定律重新被發現後的第九年,在德國發表了兩篇研究報告,一篇是Correns關於紫茉莉(Mirabilis)的工作;另一篇是Baur關於天竺葵(Pelargonium)的工作。這兩種植物的花色與葉色遺傳,均明顯地不屬於核遺傳。以後,其他學者又在月見草屬(Oenothera)及柳葉菜屬(Epilobium)中觀察到類似情況。人們把這一類用孟德爾用豌豆所發現的遺傳定律不能解釋的遺傳現象稱為細胞質遺傳、母體遺傳、單一親本遺傳、非孟德爾遺傳、核外或染色體外遺傳,或者根據最近的發展,更確切地分為葉綠體遺傳及線粒體遺傳等等。但是,對這一現象的實質卻一直不清楚。直到60年代初,當第一次肯定葉綠體及線粒體中存在DNA之後,關於細胞質遺傳的研究才揭開了新的一頁。
發展
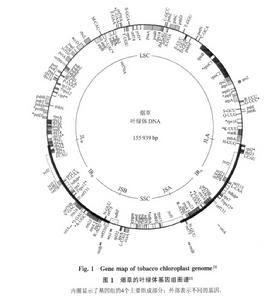 菸草葉綠體基因組圖譜
菸草葉綠體基因組圖譜第一次明確肯定植物細胞的葉綠體中含有DNA的報導是1962年。此後的許多研究確定高等植物葉綠體DNA為閉合環狀雙股結構,環狀分子的外形長約40μ上下。浮力密度為1.696—1.697gcm3。而它們的核的DNA分子則為線形,浮力密度介於1.691—1.702gcm3之間。二者極為相近,因而,用離心法不易區分。藻類葉綠體DNA的浮力密度均較它們相應的核DNA為輕,在密度梯度中很易區分開來。
高等植物中每個葉綠體所含DNA總量為2—10×10-15g,而高等植物葉綠體基因的大小為1—2×108道爾頓。這樣,每個葉綠體所含的DNA總量,大約相當於10—30個基因的大小。換言之,每個葉綠體中大約含有10—30個基因。當然,這裡應該說明,文獻中有關這一問題的報導並不是一致的。
從高等植物葉綠體中最早成功地分離出核糖體也是在1962年。當時就發現植物細胞中有兩類核糖體:70S與80S。70S核糖體位於葉綠體中,分子量為3×106;80s核糖體位於細胞質中,分子量為4—5×106。在鹼基成份方面,葉綠體核糖體RNA與細胞質核糖體RNA也不同。對於抗生素的作用,兩種核糖體也表現出特異的反應。例如,氯黴素可抑止70S核糖體中蛋白質的合成卻無礙於80S核糖體。相反,環己胺抑止80S核糖體蛋白質的合成卻無妨於70S核糖體。利用這個原理,可以研究離體葉綠體的體外活性。
在低濃度的Mg 離子作用下,70S核糖體分解為50S及35S兩個亞基,當Mg 濃度恢復時,又可組成70S核糖體;80S核糖體在沒有Mg 情況下,需要延長透析分解為亞基60S及40S,當Mg 恢復後則不能再重新組成80S核搪體。
葉綠體核糖體RNA(rRNA)是由葉綠體DNA編碼的;同一細胞的細胞質核糖體RNA,則是由核DNA編碼的。
除rRNA以外,葉綠體也具有自己的mRNA及tRNA,且各自具有轉錄、翻譯功能。葉綠體mRNA的功能可以通過離體葉綠體合成蛋白質來鑑定,已經證明,豌豆的離體葉綠體能將S35標記的放射性甲硫氨酸摻入到五個不同的與膜結合的蛋白質中;菠菜離體葉綠體至少有九種與膜結合的蛋白質被體外標記。此外,利用上述蛋白質合成的特異性抑止劑,亦可以鑑定出mRNA的活性。
有充分的證據表明:葉綠體DNA編碼的遺傳信息,是在葉綠體中翻譯的,而核DNA編碼遺傳信息則是在細胞質中翻譯的。
葉綠體中含有tRNA,同細胞質中所含的不同。除相應於普通胺基酸的tRNA分子外,已經在葉綠體中發現有不同的、可以接受同一胺基酸的tRNA(稱為同功tRNA)以及葉綠體特異的氨醯-tRNA合成酶。
葉綠體基因組基因表達調控
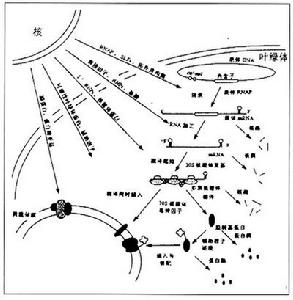 葉綠體基因組代謝調控機制簡圖
葉綠體基因組代謝調控機制簡圖葉綠體基因組的特點是具相同或相關功能的基因組成複合操縱子結構。這一特點有利於葉綠體基因的表達與調控,例如rpoB-rpoC-rpoC2操縱子是由編碼RNA聚合酶各個亞基的基因聚合在一起而形成的,而psbI-psbK-psbD-psbC操縱子則編碼PSⅡ的部分蛋白質。下面分別介紹一下葉綠體基因組基因表達調控方式。
轉錄水平調節
整體轉錄活性與葉綠體RNA聚合酶水平有關
參與葉綠體基因轉錄作用的RNA聚合酶至少可分為兩種不同的活性類型,一種是由葉綠體基因編碼的可溶性RNA聚合酶,根據同大腸桿菌相應序列同源性的比較分析,已鑑定出葉綠體基因rpoAV、rpoB、rpoC1和rpoC2,分別編碼著葉綠體可溶性RNA聚合酶的α、β、β'和β″亞基。另一種是由核基因組編碼的葉綠體RNA聚合酶,主要轉錄rRNA基因。它是同葉綠體DNA緊密結合形成的複合物,特稱為轉錄活躍的染色體(transcriptionallyactivechromosome)簡稱TAC。研究表明RNA複合酶的增加水平與轉錄活性平行。
與附加因子相關
為了精確地啟動葉綠體基因的轉錄作用,還需要若干附加因子參與。目前已從玉米、菠菜等植物中分離了這類因子,如S因子和δ類因子(sigma-likefactors,簡稱SLF)等等(Surzycki,1976;Bulow,1988;Lerbs,1988)。實驗證明葉綠體基因的轉錄起始是由SLF和啟動子共同控制的。
葉綠體基因轉錄活性改變與葉綠體DNA分子拓撲學改變有關
由於超螺鏇度局部改變可影響啟動子活性,因而導致葉綠體基因組的整體轉錄或個別啟動子的活性變化。葉綠體RNA聚合酶對超螺鏇的模板活性和忠實性比鬆散型模板要高(Jolly,1980;Crossland,1984;Stirdivant,1985;Lam1987;Russell,1987)。
與啟動子強度相關:葉綠體RNA水平一方面是由轉錄速度決定的,但相對啟動子強度亦構成轉錄活性差異的重要因素。
葉綠體DNA甲基化對轉錄水平的影響:關於葉綠體DNA甲基化對轉錄水平的影響還存在一定爭議。對蕃茄葉綠體的研究表明(Kobayashi,1990)DNA甲基化可降低轉錄水平,而對豌豆葉綠體DNA甲基化研究中卻發現並不影響基因的表達水平。因此甲基化對轉錄水平的影響還有待於更深入的研究。
轉錄後調節與修飾
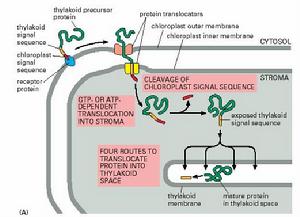 葉綠體蛋白的轉運
葉綠體蛋白的轉運萊茵衣藻核基因組與葉綠體基因組遺傳轉化體系的建立,以及許多光合途徑缺陷突變體的分離為研究轉錄後調節提供了一個非常有用的模式系統。遺傳分析表明RNA加工和RNA編輯為影響葉綠體基因表達轉錄後調節的因素。
RNA加工:由於葉綠體基因組織結構多為多順反子操縱子,因此,其mRNA的加工必定成為基因表達調控的一個重要環節(Barkan,1988)。葉綠體RNA加工模式在不同植物中是保守的。葉綠體基因組中約40個基因含有內含子(Sugiura,1992),大多數葉綠體內含子以類似核和線粒體內含子切除方式剪接。
RNA編輯(editing) :RNA編輯是指RNA轉錄過程中或轉錄後發生一些鹼基轉換(transition)、插入或缺失而導致基本密碼潛力改變的一種轉錄後修飾。大多數植物葉綠體都存在RNA編輯,與植物線粒體系統相似,是由C-U變化來改變密碼子內部而引起胺基酸的改變(Hoch,1991;Kudla,1992)。RNA編輯機制十分複雜,可能與多肽因子及轉錄活性因子參與有關(Zelts,1993)。
翻譯水平調節
翻譯水平調節可使生物快速地適應外界環境條件,特別對於高效表達基因,當環境條件不利時,可通過翻譯水平快速調節,從而減少代謝能源的消耗。RNA水平(Michaels,1990)和細胞器代謝狀態(Scheibe,1990;Reinbothe,1991)影響葉綠體蛋白的翻譯,這種調節可能是通過核糖體蛋白反式磷酸化來完成的(Guitton,1984;Poson,1984)。
翻譯後調節與修飾
許多參與光合作用的蛋白需要一些非共價結合的輔基,如:一些金屬離子,才能形成功能蛋白,有些輔助因子(cofactor)還可以防止合成蛋白被蛋白酶水解。對於質體編碼的葉綠素(-脫輔基蛋白的積累,就需要輔基因子存在(Klein,1988;Eichaker,1990;mullet,1990)。葉綠體中蛋白酶對翻譯後調節至關重要(Mishkind,1985),一些不能裝配成功能蛋白的蛋白亞基的降解對葉綠體是一種保護措施,如:在光合傳遞鏈中氧自由基可損壞光系統的D1蛋白,而蛋白酶可降解這些無功能蛋白(Kyle,1984;Ohad,1984),從而保證葉綠體正常代謝。翻譯後調節與修飾是葉綠體基因組表達調控中不容忽視的最後一步調節。
細胞核與質體基因組的相互作用
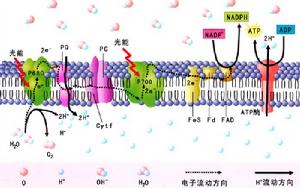 葉綠體的電子傳遞
葉綠體的電子傳遞雖然質體DNA可以編碼產生自身所需要的蛋白,但其大部分蛋白是由核基因編碼的。合子中的前質體處於一種未分化的基礎狀態,即使在胚胎髮育早期複製前質體時,質體的轉錄和翻譯仍然處於一種低水平。當胚胎開始分化為根、莖原基時,前質體獲得第一個發育信息,它激活一組基因,其產物可能只在分生組織中起作用,然後第二組基因產物對葉細胞發育起特異作用(Jaylor,1989),它們一方面激活和提高前質體轉錄水平以及使前質體分化為葉綠體,一方面激活編碼葉綠體蛋白的核基因表達,以及合成使質體RNA穩定的多種蛋白因子,這組基因的表達可能取決於細胞的位置信息,即由於細胞位置的不同,導致某種特異調節分子相對濃度不同。在每個葉原基細胞增殖過程中,位置信息決定細胞命運,因而不同細胞如葉肉細胞、皮層細胞、保衛細胞中對葉綠體的發育進行微調,大多數是通過調節RNA穩定性、剪接、翻譯以及蛋白質穩定性來實現的,並顯示核基因可以控制那些核和質體共同編碼的、最終裝配為複合體的蛋白基因。當發育為葉片時,不同細胞類型的核基因表達有所不同,不同細胞的位置信息,通過不同的基因調節機制,引起質體和核基因的細胞特異表達。最後,葉片細胞以關掉編碼葉綠體蛋白的基因和核基因表達而進入衰老階段(劉良式,1988)。
總之,基因表達調控是由一系列複雜的調控機制組成的(見圖1)(Marina,1996)。不同的調節機制在一定條件下對特定基因起調節作用,不同的調節策略可使不同植物來適應各自的生存條件,如:光、溫、水和營養條件可調節植物的代謝活動。除上面提到的環境因素外,還涉及葉綠體基因轉錄及轉錄後調節、翻譯與翻譯後修飾調節、核基因對葉綠體基因在轉錄與翻譯過程中的調節和質體產生的信號對核編碼的質體蛋白的表達調節等等。因此,很難對葉綠體基因表達找出一個固定模式。在未來的研究中,核基因組和質體基因組如何在質體發育過程中起到相互調節作用將會成為一個最可能出成果的研究領域。
葉綠體遺傳的研究途徑
 葉綠體遺傳研究
葉綠體遺傳研究葉綠體遺傳的研究可以從不同的途逕入手。
第一,研究葉綠體DNA序列組成的差異
據估計,葉綠體DNA基因組含有至少能編碼二百種蛋白質的信息。因此,任何葉綠體遺傳的差異,最根本的也就反映在葉綠體DNA鹼基序列組成上的差異。通過對葉綠體DNA的分離及序列組成分析,可以測知這種差異的有無及程度,甚至可以繪製成DNA序列圖。
例如,高等植物的細胞質雄性不育性,有一部分是受葉綠體DNA所控制的。通過分離葉綠體DNA,並用核酸內切酶消化,最後對比電泳後的DNA斷片圖式,就有可能測得不育系葉綠體DNA與可育系之間的差異。或者,更進一步採用多種內切酶處理並結合DNA-RNA分子雜交技術,就可能繪製出整個或部分葉綠體DNA的序列組成圖。國內外很多學者正是這樣進行工作的。
第二,研究DNA編碼的蛋白質的差異
葉綠體編碼的蛋白質,文獻中報導的涉及若干種。但是,比較肯定的只有兩種:組分Ⅰ蛋白質大亞基及光系統Ⅰ葉綠素蛋白質。
組分Ⅰ蛋白質又稱雙磷酸核酮糖羧化酶(簡寫作RuBPC酶)最近幾年利用菸草屬的不同種進行了許多研究,採用等電聚焦電泳可以把這種酶的大、小亞基分離:大亞基被分為分子量相同等電點不同的三種多肽,小亞基被分為兩種多肽。由於大亞基多肽是葉綠體DNA編碼的,小亞基是由核DNA編碼的,種間雜交的雜種F1永遠具有母本種的大亞基併兼有父母本的小亞基。根據這一原理,就可將任何葉綠體DNA控制的性狀,通過雜交再用F1同親本之一回交的方法,重新創造出大亞基相同小亞基不同或小亞基相同而大亞基不同的組分Ⅰ蛋白質,並通過等電聚焦技術對所得結果進行鑑定比較。
光系統Ⅰ葉綠素蛋白質,又稱P700-葉綠素a蛋白質。它是研究質體基因突變的一個最常用的指標,是一種重要的色素-蛋白質複合體。任何色素的突變,均常常在這裡反應出來。限於篇幅,這裡不再詳細介紹了。
第三,葉綠體與原生質體融合或葉綠體被原生質體吞食
近年來,在高等植物體細胞融合工作的影響下,開展了一些高等植物原生質體與藻類細胞融合或吞食藻類細胞的研究,並取得了初步成果。這表明,在一定的培養條件下,藻細胞進入高等植物原生質體中是完全可能的。
在這方面,最有意義的是Carlson進行的工作。他利用菸草的白色突變體的原生質體置於含有正常野生型原生質體的培養基中,觀察到正常葉綠體進入到白色突變體的原生質體的細胞質中,並在其中複製並起作用,由此再產生成一個新的植株。因為同一細胞中除去外來的野生型葉綠體外,還保留有突變體的白色質體,故整個新形成的植株,可以再生含有外來葉綠體的白色原生質體。最近不少人進行了類似的試驗,但真正能得到這樣結果的極少。
葉綠體遺傳工程的重大進展
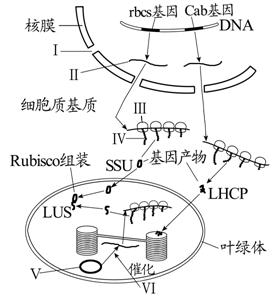 葉綠體遺傳
葉綠體遺傳對於大部分被子植物來說,質體基因以嚴格的母系單親的方式進行遺傳。儘管轉基因葉綠體只存在於花粉中,但是質體DNA在雄性精子細胞發育過程中會被清除,清除的具體時間隨物種而異。這種策略減少了轉基因植株與雜草或農作物遠源雜交的可能性,同時也減少了轉基因花粉對其他昆蟲的潛在毒性。因此,母系遺傳對葉綠體轉基因提供了一定的防護,使其不會通過花粉四處傳播。
質體基因轉化還存在另外一個優勢,那些在胞質中產生毒性的外源基因或者基因產物可以通過葉綠體表達。霍亂毒素B亞基(CTB)是霍亂的口服疫苗的有效成份,可以通過轉基因質體進行大量表達,而通過細胞核表達,很低的濃度也會對葉子產生毒性。類似的,海藻糖是製藥工業上常用的防腐劑,其在胞質中表達會產生很大的毒性,而在質體中表達沒有任何副作用。工業上十分重要的木聚糖酶在葉綠體中大量表達不會產生細胞壁降解和生長受阻的現象,而在細胞核的基因轉化株中會有這些現象。
另外,在葉綠體基因組的基因間區域特異位點進行轉基因,可以避免細胞核轉基因植物中經常出現的位置效應。葉綠體上所有的轉基因產生的外源蛋白都具有相同的表達水平,而且在細胞的各種生理狀況下變化不大。外源基因的位點特異性整契約時也避免了載體序列的引入,載體序列在細胞核基因轉化中也是很大的潛在危險因素。在葉綠體轉基因植物中,外源轉錄產物比細胞核轉基因植物高168倍,也沒有發生基因沉默。同樣,在葉綠體轉基因植物的葉子中,即使外源蛋白占總蛋白質的46%,也不會發生轉錄後基因沉默現象。
通過單次基因轉化可以在葉綠體中實現多個基因的轉化。例如,把蘇雲金芽孢桿菌(Bt)的cry操縱子進行轉基因,這種殺蟲劑蛋白的產物δ-內毒素占葉子中總蛋白的46%。細菌中有兩種抗不同形式汞的酶——汞離子還原酶(merA)和有機汞裂解酶(merB)——在葉綠體中對此操縱子進行轉基因,轉基因植物對高劑量的汞和有機汞複合物都有耐受性。細菌PHB操縱子的3個基因在葉綠體中表達可以得到大量的PHB複合物。現在,通過質體表達外源基因已經可以對農作物改良,也可以用來表達治療性蛋白質。除了胡蘿蔔以外,以前幾乎所有的質體基因轉化都是在菸草上進行的。
質體遺傳工程的局限性
質體基因轉化還只是在菸草中最成功,把這項技術套用到其他通過體細胞胚胎髮生再生的農作物的最大障礙是沒有找到合適的組織培養和植株再生方法,缺少選擇性標記,並且只有綠色質體才能表達轉基因。首先面臨的困難是怎樣把外源DNA導入各種各樣的非綠色質體,如原質體、白色體、造粉體、白色質體、有色體、造油體和衰老體,這些質體的基因表達和調控系統與綠色的成熟葉綠體差異很大。要表達外源基因,首先需要清楚這些非綠色質體中的調控序列。除此之外還有一個很大的困難,如何通過體細胞胚胎髮生保持葉綠體轉基因同型異源體植株的能力;一般來講,植株再生後期會失去胚胎髮生所提供的優勢,因為分割的體細胞胚胎無法再生成整個植株。
 葉綠體起源
葉綠體起源通過器官發生的方式,已經實現了擬南芥、馬鈴薯和西紅柿等植物葉綠體基因轉化,只是轉化效率比菸草葉綠體低得多。在擬南芥中,轟擊後的細胞培養物每40或者151個篩選才能得到一個葉綠體轉基因系,這個轉基因系還不一定是可育的。馬鈴薯中每25個篩選能夠得到一個轉基因系,在西紅柿中每10個篩選得到一個。而菸草的轉化效率非常高,從一片被轟擊的菸草葉子中可以得到高達14個的葉綠體轉基因系。
對於油料作物Lesquerella而言,轉基因克隆必須嫁接到甘藍型油菜中才能得到種子,51次篩選僅僅得到2個葉綠體轉基因克隆。在大豆中,對懸浮的胚胎髮生培養物進行984次轟擊,只出現一次異質體現象,還是無法進行傳代的異質體。在水稻中,用PCR分析證明發生了短暫的基因整合現象,但沒有形成穩定的整合;轉基因植株高度的異質體化,而且轉基因不能被攜帶到子代植株中去。同樣,在油菜中用Southern分析轉基因的葉綠體基因組沒有發現形成同型異源性。組織培養的局限性和非綠色移植經常被認為是葉綠體轉化套用在茄屬作物上的最主要障礙。
雖然有上述的困難和限制,最近質體遺傳工程已經成功的套用到了幾種主要作物上,包括棉花、大豆、胡蘿蔔。
胡蘿蔔質體基因組轉化
在世界各地,胡蘿蔔(DaucuscarotaL.)是人類和動物一種重要的蔬菜來源,它含有豐富的糖、維生素A和C、纖維。胡蘿蔔是典型的鹽敏感植物,在鹽分高於20mM的時候,鹽濃度每升高10mM,其產量下降7%。因此,胡蘿蔔是一個通過基因工程的方法提高抗鹽性的首選作物。
鹽分是造成農業減產的一類主要的無機物。由於大規模灌溉和化肥的大量使用,土壤中的鹽分的問題十分複雜。世界上有20%的灌溉田受到鹽分問題的影響。現在,高鹽分使美國30%的灌溉田作物減產,總計達2,000萬公頃。滲透保護是機體代謝上對鹽刺激的一個適應,氨基乙酸三甲銨乙內酯通過保持環境的滲透壓平衡和穩定複雜蛋白質的四級結構來減少細胞受到高鹽的影響。細胞核轉基因植物體內表達氨基乙酸三甲銨乙內酯可以提高其對鹽刺激的耐受水平,這方面內容已經有相關的文章報導。
Kumar等人最近首先報導了通過體細胞胚胎髮生的方法成功進行質體遺傳工程的例子,他們使用非綠色質體轉化外源DNA。用培養的轉基因愈傷組織表達三甲銨乙內酯乙醛脫氫酶(badh),這些細胞甚至不經過任何選擇就已經是綠色,而沒有轉基因的細胞為黃色。與沒有基因轉化的細胞相比,100mM的NaCl使轉基因胡蘿蔔細胞中BADH的酶活性提高了7倍。如果把胡蘿蔔葉綠體中的BADH表達看作100%,在含有成色素細胞的非綠色可食用部分表達是74.8%,而在培養細胞的原生質體中的表達是53%。在100mMNaCl情況下,基因轉化的胡蘿蔔細胞的三甲銨乙內酯的表達比沒有基因轉化的細胞高50~54倍(通過1H-NMR測得)。這裡的三甲銨乙內酯濃度和鹽土植物中測得的濃度相當。轉基因胡蘿蔔中BADH的表達使它們可以耐受高濃度的鹽分(NaCl的濃度達400mM),這是迄今為止文獻報導中鹽耐受的最高水平。
胡蘿蔔是理想的
口服治療性蛋白質表達體
 白色體
白色體葉綠體遺傳工程最適合表達高水平的疫苗抗原,生產治療性蛋白質。已經有幾種治療性蛋白質通過轉基因菸草的葉綠體表達,包括霍亂、炭疽熱、鼠疫和破傷風疫苗抗原,單克隆抗體,和其他的用在人身上的治療性蛋白質:人生長激素、人血清白蛋白、干擾素、類胰島素生長因子和抗菌蛋白等。然而,現在急需的還是利用基因工程方法生產口服的治療性蛋白質和疫苗抗原。口服製劑可以大大降低生產、純化、冷藏和運輸成本,並且能夠避免靜脈注射引起的併發症。
胡蘿蔔是表達治療性蛋白質的最佳選擇,因為整合轉基因質體的基因組通過母系遺傳,並且對於這個兩年生植物來說,在生長的第一年不開花即可收穫塊狀根。這兩個特徵使胡蘿蔔作為製藥作物不會對食用作物造成任何污染,符合各級管理機構的要求。胡蘿蔔體細胞胚胎來自於單個細胞,通過多級胚胎髮生增殖而成,並且可以在體外培養保持數年;從而可以提供統一的細胞源,這對生產治療性蛋白質是必須的(來源統一)。胡蘿蔔細胞分裂速度快,用生物反應器能夠產生大量細胞。攜帶治療性蛋白質的胡蘿蔔細胞不需要進行任何烹飪,這樣在服用時可以更好的保護治療性蛋白質的完整性。利用人造種子技術,體細胞胚胎可以冷藏保存數年的時間。因此,攜帶藥性和增強營養水平的轉基因胡蘿蔔有至關重要的藥用價值,能夠大大提高人類的健康水平。然而必須說明的是,含有治療性蛋白質的新鮮蔬菜絕對不能直接口服,必須把細胞凍乾,包裝成膠囊,按計量服用。
轉基因可以在胡蘿蔔培養細胞的原質體中大量表達,與以前的報導相比,這是很大的突破。在以前的研究中,馬鈴薯莖中澱粉質體綠色螢光蛋白(GFP)的濃度不到葉子中的1%。胡蘿蔔培養細胞原質體和成色素體中BADH的活性分別是葉子葉綠體中的53.1%和74.8%。這項研究中使用的調控序列是16srRNA啟動子、T7基因10的5’非翻譯區、rps16的3’UTR,它們在所有的組織類型中都發揮功能,包括原質體、成色素體和葉綠體。這些研究結果表明,胡蘿蔔可以用來表達大量的疫苗抗原或其他治療性蛋白質,而且服用起來也更加方便。
棉花質體基因組的轉化
棉花(GossypiumhirsutumL.)是世界上最重要的天然紡織纖維的來源,也是世界上最重要的經濟作物之一。美國的纖維產量占世界的40%(年銷售額61億美元),是世界上原棉的主要輸出國之一。聯合國糧食農業組織(FAO)報告顯示,2003年棉紗布和棉籽等的產值入圍美國主要農產品20強。根據國際農業生物技術套用服務組織(ISAAA)統計顯示,美國經濟中與棉花相關的貿易每年為1,200億美元,棉花成為美國最有價值的農作物。然而,對棉花的體外基因操作非常困難,通過體細胞胚胎髮生方式不容易產生植株。
2002~2003年,通過細胞核基因組工程改造的抗蟲和抗雜草的轉基因棉花的種植占世界棉花種植的13%,而大豆是63%,玉米是19%。同期相比,美國77%的區域種植了基因改良(GM)棉花,而GM大豆是81%、GM玉米是40%。到目前而止,細胞核轉基因棉花只是在某些區域被限制的種植。陸地棉(Gossypiumhirsutum)和夏威夷棉(Gossypiumtomentosum)、弗羅里達群島的陸地棉野生種群或者維京群島和波多黎各陸地棉/海島棉在一塊都會產生雜交。因此,必須嚴格劃定一些區域進行轉基因試驗,在這些區域種植商業化的抗蟲棉花(Bt-cotton)。類似的,現在GM棉花也只能在特定的區域種植,避免使其與野生型親緣植物共存,防止遠源雜交形成親緣關係近的雜草。
有報導稱,轉基因棉花的花粉可以擴散到周圍非轉基因棉花上。Umbeck等人在研究花粉從轉基因棉花到傳統棉花區域的擴散問題時發現,儘管有緩衝帶隔離,它們之間仍有5.7%的互相雜交率。葉綠體基因工程可以避免轉基因棉花中的基因逃逸現象,因為葉綠體轉基因是通過母系遺傳的。對於表達Bt毒素的GM農作物,研究人員還關心另外一個問題,毒素沒有形成終產物,害蟲可能產生抗Bt的抗性。另外,利用細胞核基因工程產生抗蟲棉花對外源基因的表達量太低,不能有效保護植株不受害蟲的侵害,還必須結合其他幾種噴霧殺蟲劑進一步減少害蟲造成的損失。
Kumar等人最近證明,可以對棉花質體進行基因轉化,獲得穩定的母系轉基因遺傳。體外產生的轉基因棉花系與非轉基因的植株在栽培室中以相似的條件生長,葉綠體轉基因棉花和未基因轉化的棉花沒有任何區別,從初花、開花、結桃,到種子成熟,都沒有任何異常。F1子代十字雜交(非轉基因-轉基因)的種子能在卡那黴素選擇性培養基上發育,但是不能長大,而轉基因種子能夠抗卡那黴素正常的生長,長出很多的根和葉。這進一步證明了先前棉花葉綠體基因組不是通過父系或者雙親遺傳,而是通過母系進行遺傳的結論。葉綠體轉基因植株自授粉的種子可以在卡那黴素上生長,因此這些種子試驗是非孟德爾式遺傳。
大豆質體基因組的轉化
大豆(GlycinemaxL.Merr.)是豆科農作物,也是蛋白最主要的來源,是人類和動物最普遍的食物之一。乾大豆含大約20%的油和35~40%的高營養蛋白。大豆也是一個重要的GM農作物,GM大豆的種植占2003年世界大豆種植的一半以上,農民願意種植這種草甘膦耐受的細胞核轉基因株。目前,更多的工作致力於改造抗害蟲工程株,並提高抗病能力和油的質量。儘管尚無報導,如果利用大豆質體基因工程得到這些工程株,就會取消只能在特定區域內種植轉基因大豆的限制,因為大豆質體基因組同樣也是母系遺傳的。
組織培養是大多數植物基因轉化中至關重要的一步。因為能夠發育成完整植株,體外培養的大豆胚胎髮生組織是點轟擊方法進行細胞核基因轉化的最常用材料。然而,像它的堅硬豆莢一樣,對大豆進行基因轉化仍然十分困難。大豆胚胎髮生過程中未分化細胞僅包含少量的十分微小的質體,因此對大豆葉綠體進行基因轉化很困難。現在基因組資料庫中還沒有大豆質體基因組全序列,這也是大豆質體基因轉化的一個很大障礙。
Zhang等人首先嘗試進行大豆葉綠體的基因工程,他們希望提高大豆的光合作用能力。Dufourmantel等人最先利用體細胞胚胎髮生方法成功實現大豆葉綠體基因工程,他們得到了可育的葉綠體轉基因植株。其轉化效率非常高,每次轟擊得到2個轉化,是馬鈴薯、西紅柿、擬南芥中葉綠體基因轉化效率的15~100倍。表型正常的轉基因植株可以通過體細胞胚胎髮生得到。所有葉綠體轉基因植株都是完全可育的,並且其產生種子也可育。T1後代全部具有抗生素抗性,這說明轉基因是穩定的,並且是通過母系遺傳。
引入抗生素抗性基因,用細菌調控元件控制這個基因,這樣更容易被公眾接受。可以對大豆設計選擇性標記,如除草劑抗性基因或者BADH。但是,選擇性標記有其局限性,除草劑抗性基因不能用來進行第一輪篩選,奇黴素選擇性對一些作物是致死的,棉花就是其中之一。BADH不能套用在內源的氨基乙酸三甲銨乙內酯表達量高的作物上。這裡只是提供了另外一個選擇,不同系統對標記的清除能力不同,取決於兩個直接重複間的同源重組,或者是位點特異重組系統,如Cre-Lox,或者是完全清除整合標記基因。
主要農作物中質體基因轉化成功的原因
雖然上述幾種農作物要進行基因轉化都非常困難,但是最近這些物種都獲得了高效質體基因轉化。馬鈴薯、西紅柿和油料作物Lesquerella葉綠體基因轉化的載體包含菸草或者擬南芥葉綠體的前後端序列,可能是導致這些農作物基因轉化效率低的原因。菸草質體基因轉化用的是自身的前後端序列,其效率非常高。用矮牽牛花的前後端序列進行菸草葉綠體基因轉化時,轉化效率急劇下降。其他幾個例子用的是非100%同源的質體DNA序列,質體基因轉化效率也非常低。因此,雖然萬能載體的概念已經提出幾年了,可以用來轉化幾個親緣關係近的作物(例如,菸草、西紅柿和馬鈴薯),但是還需要物種特異載體進行質體基因轉化,尤其是那些比較挑剔的物種。這樣的研究需要預先知道相關作物葉綠體的基因組序列。不幸的是,在已經發布的40多個葉綠體基因組和200多個正在測序物種中,只有6個是農作物葉綠體的基因組。
要了解和操作體細胞胚胎發生系統非常困難,利用異源質體組織繁殖,在隨後的循環中轉基因會失去優勢。在基因轉化過程中,非綠色組織中的原質體必須成為成熟的葉綠體,並且轉化細胞在發育的各個階段都必須承受選擇壓力。因此,最大困難是質體必須在有無光照的條件下都能夠承受選擇壓力,並且在發育的各個時期都是這樣。植物細胞經過轟擊後,形成一兩個成功基因轉化的葉綠體細胞,這一點尤為重要。必須依靠選擇壓力使基因轉化質體存活,而其他基因轉化失敗的質體在選擇壓力下會消失,相反,基因轉化質體不斷增殖並確立它們的優勢地位。
棉花質體基因轉化“雙槍”載體可以同時攜帶兩個基因,它們編碼兩種不同的蛋白質,共抗同一種或同一類毒物,其調控信號在原質體和成熟的葉綠體中都起作用。基因aphA-6和aphA-2(nptII)都編碼氨基葡糖苷磷酸轉移酶家族蛋白,但是它們起源於不同的原核生物。
兩種酶有著類似的催化活性,aphA-6的基因產物還能夠解毒卡那黴素,並且能對廣譜的氨基葡糖苷解毒,包括氨基羥丁基卡那黴素A。兩種轉基因(aphA2或nptII和aphA6)都被全長的質體Prrn啟動子轉錄,這個啟動子包含細胞核和質體編碼的兩種RNA多聚酶,因此可以認為它在原質體中和成熟葉綠體中都發揮作用。基因aphA-6也被T7基因10的5'UTR進一步調控,從而它能夠在黑暗的條件下,在非綠色組織的原質體中高效表達。rps16的3'UTR用來穩定基因aphA-6的轉錄。把T7基因10的5'UTR和rps16的3'UTR使BADH在胡蘿蔔葉子葉綠體中的表達升高看作100%,那么在含有葉綠體的可食用的非綠色組織中的表達升高為74.8%(在地下黑暗的環境中),在原生質體中的表達升高為48%。因此可以認為,非綠色和綠色質體中的基因aphA6在有無光的條件下都會表達。
棉花質體基因轉化載體中的nptII基因被psbA5'和psbA3'UTRs驅動,已經多次證明這些序列以光依賴的方式對整合轉基因的質體表達進行調控。從而可以作出推測,卡那黴素在有光無光的條件下都會被降解。因此,aphA-6和aphA-2基因聯合在原質體和葉綠體中通過光信號進行調節,在選擇壓力存在的條件下持續對質體/葉綠體的轉化基因提供保護。利用單基因的調控序列,儘管轉基因在不同類型的質體中都能有效的表達,但是棉花的單個基因的轉化效率僅為5%,大大低於“雙槍”載體的42%。與之不同的是,光調節因子(rbcL5'UTR和psbA3'UTR)驅動的單個選擇標記基因(aadA)對大豆的質體基因轉化效率很高,因為轉化時轟擊的原始材料已經是綠色,含有成熟葉綠體,並且支持光合作用活性。
胡蘿蔔和棉花具有較高基因轉化效率可能還有一個原因,載體的前後端序列比較長,其中有葉綠體DNA的複製起始點,從而為轉基因整合提供更多的模板。例如,分別用具有oriA的葉綠體載體和沒有oriA的葉綠體載體轟擊培養的菸草細胞,只是那些有oriA的載體整合到trnI基因上,載體上的轉基因被表達,產生很高的氯黴素乙醯基轉移酶(CAT)活性。同樣用兩類葉綠體載體攜帶相同的基因分別轟擊細胞,具有oriA的載體整合到基因trnI的側序列,甚至可以在第一輪篩選中形成同型異源體。菸草葉綠體基因組的複製起始點已經被定位,oriA位於基因trnI中;基因trnI在棉花和胡蘿蔔基因轉化中位於葉綠體轉化載體的5’端上游。另外,這個有轉錄活性的空白區域是轉基因整合的首選位置,在這個位置進行的轉基因大大多於其他位置。
結語
質體基因轉化改善了重要農作物的性狀,也有利於生產生物材料和治療性蛋白質,如抗體、生物藥物和疫苗抗原,等等。通過轉基因葉綠體的高水平基因表達,可以生產大量低成本的治療性蛋白質。像層析法這樣的純化方法在這兒根本不需要,口服治療性蛋白質根本不需要進行純化。正因為如此,幾家主要的生物技術公司已經啟動研究項目,目的是把這項技術商業化。
最近的研究認為,利用體細胞胚胎或胚胎髮生愈傷組織產生質體基因轉化系統的意義十分重大,很有可能會開創幾種主要農作物質體基因組工程,它們需要通過體細胞胚胎髮生實現植株再生。現在,在很多作物上都已經實現了用體細胞胚胎髮生的方式實現植株再生,包括穀類、豆類、油類作物、商品作物、蔬菜作物、水果/樹和堅果、飲料、木材,等等。
另外,質體基因轉化已經成為研究質體發生和功能的一個有力工具。這個工具被用來研究質體DNA複製起始點、RNA編輯元件、啟動子、RNA穩定因子、多順反子加工、內含子成熟、翻譯元件和蛋白質水解、一些重要蛋白質和其他幾個過程。因此,最近的進展對這些方面來說都是很好的開端,包括用轉基因質體生產治療性蛋白質、疫苗和生物分子,用無污染方法改良農作物,對質體的生物化學和分子生物學有更深入的了解。