 | |
| 氫硫酸 | |
基本概況
 | |
| 氫硫酸 | |
化學分析
 | |
| 氫硫酸 | |
1、硫化氫的物理性質:無色,有臭雞蛋氣味的氣體,有毒。
2、化氫的分子結構:為極性分子。
3、化氫的化學性質:
(1)不穩定性
硫化氫在較高溫度時,分解成氫氣和硫。請寫出分解的化學方程式,並比較硫化氫與水的穩定性,從而比較氧和硫元素的非金屬性的強弱。實驗從貯氣瓶中取硫化氫氣體,點燃,觀察燃燒現象。寫出化學方程式。
(2)可燃性:
2H2S+3O22SO2+2H2O(完全燃燒)
2H2S+O22S+2H2O(不完全燃燒)(無↓符號)
注意:n(H2S)/n(O2)=a
完全燃燒時,a=2/3,產物為SO2,不完全燃燒時,a=2,產物為S,當2/3〈a〈2時,產物為S和SO2。
在硫化氫的可燃性中,也表現了其具有還原性。
(3)還原性:
硫化氫中的硫顯-2價,它為硫的最低價,又硫元素的非金屬性不是很強,硫原子得電子的能力不太大,故硫化氫的還原性較強。硫化氫的還原性主要表現在以下幾個方面:
H2S+Cl2=S+2HCl
2H2S+SO2=3S+2H2O
H2S+2FeCl3=S+2FeCl2+2HCl
與硫化氫
 | |
| 氫硫酸 | |
1、狀態不同:硫化氫在常溫下是氣態,而氫硫酸在常溫下是液態。
2、組成不同:硫化氫是純淨物,只有一種分子(硫化氫分子)組成;氫硫酸是溶液,屬混合物,含有不同的分子和離子(硫化氫分子、水分子、H+、S2-、HS-、極少量OH-)。
3、性質不同:硫化氫在與其它物質反應時只表現出還原性,氫硫酸可表現出酸性、氧化性和還原性。
a硫化氫能在空氣中燃燒,發出淡藍色火焰;氫硫酸不能燃燒。
b氫硫酸具有酸類的通性,能使藍色石蕊試紙變紅,與鹼發生中和反應;硫化氫氣體只能與鹼溶液反應,不能使乾燥的藍試紙變紅。
c氫硫酸中的硫化氫有一小部分發生電離,能電離出很少量的H+,這些H+可表現出弱氧化性。如氫硫酸與鎂粉反應
Mg+H2S(水溶液)==MgS+H2↑
d氫硫酸極易被氧化,氫硫酸的還原性比硫化氫更強,氫硫酸在空氣中放置時就會被空氣中的O2氧化或與SO2反應而析出硫單質:
2H2S(溶液)+O2==2S↓+2H2O
2H2S(氣體)+SO2==3S↓+2H2O
常用方程式
 | |
| 氫硫酸 | |
HS-H++S2-
H++S2-=HS-
H++HS-=H2S
H2O+S2-HS-+OH-
HS-+H2OH2S+OH-
H2S+OH-==HS-+H2O
HS-+OH-==S2-+H2O
H2S+Cl2==2Cl-+2H++S↓
2H2S+SO2==3S↓+2H2O
2H2S+O2==2S↓+2H2O
H2S+Cu2+==2H++CuS↓
H2S+(CH3COO)2Pb==PbS↓+2CH3COOH
H2S+2OH-==S2-+2H2O
3HS-+Al3++3H2O==Al(OH)3↓+3H2S↑
製作方法
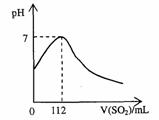 | |
| 氫硫酸 | |
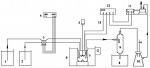
裝置:啟普發生器(與H2、CO2相似)
原理:FeS+2HCl=FeCl2+H2SFeS+H2SO4=FeSO4+H2S
收集:向上排空氣法
驗滿:濕潤的藍色石蕊試紙或硝酸鉛試紙
除雜質:吸HCl:飽和NaHS溶液
吸水:CaCl2固體或五氧化二磷固體
尾氣吸收:用NaOH溶液
相關詞條
參考連結
1、http://engine.cqvip.com/content/o/83239a/2006/021/006/zk25_o4_22398457.pdf
2、http://www.90house.cn/gaozhonghuaxuezt/20080518/794.html

