簡介
 砷
砷 砷是一種以有毒著名的 類金屬,並有許多的同素異形體,黃色( 分子結構,非金屬)和幾種黒、灰色的(類金屬)是一部份常見的種類。三種有著不同晶格結構的類金屬形式砷存在於自然界(嚴格地說是砷礦,和更為稀有的自然砷鉍礦和輝砷礦),但更容易發現的形式是砷化物與砷酸鹽化合物,總共有數百種的礦物是已被發現的。最為人所知的有 三氧化二砷(俗稱 砒霜)。
砷與其化合物被運用在農藥、除草劑、殺蟲劑與許多種的合金中。
第一次有關砷的紀錄是在1250年,由大阿爾伯特所完成。
歷史
砷的拉丁名稱arsenium和元素符號As正是由這一詞演變而來。
 中國古代白銅錢幣
中國古代白銅錢幣 經過分析,在中國商代時期的一些銅器中有砷,有的多達4%。銅砷合金中含砷約10%時呈現白色,有錫時含砷少一些,也可得銀白色的銅。中國古代勞動人民創造了白銅。
1世紀希臘醫生第奧斯科里底斯敘述燒砷的硫化物以製取三氧化二砷,用於醫藥中。三氧化二砷在中國古代文獻中稱為砒石或砒霜。小劑量砒霜作為藥用在中國醫藥書籍中最早出現在公元973年宋朝人編輯的《開寶本草》中。
公元四世紀前半葉,中國晉朝大煉丹家葛洪(283-363)在他的名著《抱朴子·仙藥篇》中記載了可以製取單質砷的方法。不過由於原文屬提要性質,敘述過於簡單,長期以來沒有人對它作出解釋,因而在化學史上被忽略了。但葛洪所記載的方法有可煉單質砷這一點是確鑿無疑的。這是世界上關於煉製單質砷最早的可靠記載。
西方化學史學家們一致認為從砷化合物中分離出單質砷的是13世紀德國鍊金家阿爾伯特·馬格努斯,他是用肥皂與雌黃共同加熱獲得單質砷的。比中國的葛洪大概晚了900年。
到18世紀,瑞典化學家、礦物學家布蘭特闡明砷和三氧化二砷以及其他砷化合物之間的關係。拉瓦錫證實了布蘭特的研究成果,認為砷是一種化學元素。
檔案數據
化學鍵能
(kJ /mol)
As-H 245
As-C 200
As-O 477
As-F 464
As-Cl 293
As-As 348
電離能
 砷礦石
砷礦石 (kJ/ mol)
M - M+ 947
M+ - M2+ 1798
M2+ - M3+ 2735
M3+ - M4+ 4837
M4+ - M5+ 6042
M5+ - M6+ 12305
M6 + - M7+ 15400
M7+ - M8+ 18900
M8+ - M9+ 22600
M9+ - M10+ 26400
晶胞參數
a = 375.98 pm
b = 375.98 pm
c = 1054.75 pm
α = 90°
β = 90°
γ = 120°
物理性質
化學製取砷中的灰色晶體具有金屬性,脆而硬。在613℃升華。第一電離能9.81電子伏特。砷(和一些砷化合物)在一大氣壓下加熱會升華,直接從固體成為氣體,跳過液體這一階段。液態出現在20大氣壓或以上,這也說明了為什麼它的熔點會高於沸點。
同位素
 自然砷
自然砷 自然界中存在的砷只有一種同位素,75As。在2003年,至少有33種的放射性同位素被製造出來,原子量從60到92都有。其中最穩定的是75As,半衰期80.3天。比穩定的73As衰變時傾向發生β+衰變,而那些比較重的則傾向β−衰變,但還是有些例外。
至少有十種核異性體已經被發現,原子量自66到84。其中最穩定的是68mAs,半衰期為111秒。
同素異形體
黃色As4與白磷P4的結構像磷,砷是一個極佳的範例,展現一個元素有多種的同素異形體,因為它的各種同素異形體有著截然不同的性質,最常見的同素異形體有灰色類金屬、黃砷與黑砷。
砷的最常見同素異形體是灰砷,它的結構與黑磷(β-金屬性磷)相似,並有類似石墨的分層的晶體結構。 它是由許多個由六個元素環起來的環狀結構,環與環之間也有連線。每個原子與同一層中三個相鄰的原子鍵結,並且與上層跟下層各三個的砷原子相吸引。這種相對來說比較密的結構導致他擁有5.73 g/cm3的高密度。
黃砷 (As4)是軟而且像臘的,類似P4。兩者皆是由四個原子組成一個正四面體的架構,其中每個原子都與其他三個原子以單鍵連線,使得它的鍵結有相當程度的扭曲導致它不安定。這種型態與其它型態相比是最不穩定、活性最強、較易揮發、密度較小和毒性更強的。黃砷的製造方法是把砷蒸氣放入液態氮中快速冷卻,它在光照下會迅速轉變成灰砷,此型態的密度是1.97 g/cm³。
黑砷的結構與紅磷相近。
化學性質
 含砷金屬礦石
含砷金屬礦石 游離的砷是相當活潑的。在空氣中加熱至約200℃時,有螢光出現,於400℃時,會有一種帶藍色的火焰燃燒,並形成白色的氧化砷煙。游離元素易與氟和氮化合,在加熱情況亦與大多數金屬和非金屬發生反應。不溶於水,溶於硝酸和王水,也能溶解於強鹼,生成砷酸鹽。
砷的化學性質與和他同一族的元素磷相近。就像磷一樣,它可以化合出無色、無臭、結晶型的氧化物三氧化二砷與五氧化二砷,這兩種化合物皆可潮解且在水中的溶解度極高並生成酸性化合物。
當在空氣中加熱時,砷被氧化成三氧化二砷,在反應中產生的蒸汽,有種很類似蒜的氣味。此種蒸氣可以在用槌子敲打砷黃鐵礦的時候被發現。
化學反應
1、砷可以被O 2、 F 2等氧化4As+3O2===點燃 2As2O3
2As+5F2===點燃 2AsF5
2、砷作為非金屬,也可與金屬發生反應3Mg+2As===點燃 Mg3As2
Mg3As2可以發生水解反應 Mg3As2+6H2O===3Mg(OH)2+2AsH3↑
化合物
1、砷化氫砷化氫是無色有毒氣體,分子量77.9454 不穩定,可發生可逆反應 2AsH3===2As+3H2
砷化氫是強還原劑,很容易被氧化 與氧氣反應(自燃) 2AsH3+3O2=== As2O3 +3H2O
砷化氫與氨氣不同,一般不顯鹼性,AsH3可以用於半導體材料砷化鎵 在700-900攝氏度,化學氣相沉積 AsH3+Ga(CH3)3 ====GaAs +3CH4
2、三氧化二砷三氧化二砷是毒性很強的物質,砒霜的主要成分,可用於治療癌症,是兩性氧化物 中國古代白銅錢幣
As2O3+6NaOH===2Na3AsO3+3H2O As2O3+6HCl===2AsCl3+3H2O
三氧化二砷可被一些強氧化劑氧化成5價砷
(1)、被臭氧氧化 3As2O3+2O3===3As2O5
(2)、被氟氣氧化 2As2O3+10F2===3O2+4AsF5 此反套用於製取高純度的AsF5
(3)、三氧化二砷可被過氧化氫氧化成砷酸
3、五氟化砷
五價砷的鹵化物只有五氟化砷能穩定存在,AsF5是無色氣體易發生水解反應,生成氟化氫(腐蝕玻璃的原理)
五氧化二砷是酸性氧化物,溶於水能生成三種砷酸(偏砷酸,砷酸,焦砷酸)。
4、砷酸砷酸(H3AsO4)與磷酸性質相似,其鉀,鈉,銨鹽溶於水,其他鹽一般不溶於水,
主要化合價
主要化合價:+3和+5。
0:As 砷單質
+2:As4S4 四硫化砷(雄黃)
+3:As2S3 三硫化二砷(雌黃)As2O3 三氧化二砷(砒霜)
+5:As2O5五氧化二砷(無水砷酸、砷酸酐)
-3:H3As砷化氫(胂)
來源及存在
含砷礦物
 含砷礦石
含砷礦石 雄黃(As4S4),雌黃(As2S3)是兩種天然的含砷礦物,可與氧氣發生反應。
雌黃(As2S3)發生氧化反應
2As2S3+9O2===點燃 2As2O3 +6SO2
水雄黃(As4S4)發生氧化反應
As4S4+7O2===點燃 2As2O3+4SO2
雄黃和雌黃可被Zn,C 等在加熱條件下還原,得到砷單質。
存在形式
砷有三種形式存在:零價 (As) ,三價砷 (aesenite) ,五價砷 (arsenate) ,其化合物對哺乳動物的毒性由價數的不同,有機或是無機,是氣體、液體、還是固體,溶解度高低、粒徑大小、吸收率、代謝率、純度等來決定。
存在範圍
 熔爐
熔爐 自然界中處處有砷:火山噴發、含砷的礦石。 在工廠中,砷是熔爐 ( 鉛、金、鋅、鈷、鎳 ) 的副產品,其它有可能的砷暴露如下:
1、自然界:含砷的礦石,地下水。
2、商業產品:木材保存、殺蟲劑、除草劑、防真菌劑、棉花乾燥劑、油漆及顏料、含鉛汽油。
3、食物:酒 ( 若栽培的葡萄噴灑含砷的農藥 ) 、菸草、海產 ( 尤其是貝類 ) 。
4、工廠:燃燒石化燃料、燃燒以砷化銅處理的木材,電子產業、金屬合金、製作獸皮。
5、藥物: carbasone ,草藥 (Kushthy) 過去在治療梅毒及乾癬的藥物,現在用來治療動物的抗寄生蟲藥。
人體來源
對一般人而言,砷的攝取多來自食物和飲水。對一般人而言,砷的攝取多來自食物和飲水。魚、海產、藻類中含有 arsenobetane 和 arsenocholine ,這些化合物對人體毒性低而且容易排出體外。
生產
由三氧化二砷用碳還原而製得。其中灰色晶體具有金屬性,脆而硬。
根據英國地質調查局與美國地質調查局,2005年,白砷的最大生產國是中國,囊括了接近全球產量的50%,接下來是智利、秘魯與摩洛哥,這些砷大部分是由開採得到,例如秘魯的生產多半來自於銅的開採,而中國則來自金的開採。砷是金礦、銅礦與鉛礦精練的副產品。
在有空氣的環境烘烤砷黃鐵礦的過程中,砷以三氧化二砷的形式升華,留下鐵氧化物。當在無氧的環境時,會產生出類金屬砷。當在硫或其他物質中提煉砷時,人們讓它在真空或純氫大氣中升華或在熔融的砷鉛混合物中把它蒸餾出來。
用途
木材處理
 木材防腐劑
木材防腐劑 在2002年,19600公噸的砷化合物中的九成都拿來處理木材,在2007年,仍有5280公噸的化合物中的一半被拿來處理木材。在歐盟,根據美國環境保護局的網站,自2003年12月31日,用CCA處理的木材不再被用來建造居住或公共用建築,而改由ACQ、硼酸鹽、銅唑類、環克座與普克利之類的替代處理方法。
雖然被停用了,使用砷處理過的木材的處理問題是大眾最關注的議題之一,大部分比較舊的而被處理過的木材是使用CCA處理的,用CCA處理的木材仍在大部份的國家被廣泛使用,並且曾在20世紀後半被大量的當作建材使用。雖然大部分的國家在一些研究顯示砷可能從木材中泄漏而進入附近的土壤中(例如從遊樂器材中)後將其禁用,這種風險也存在於燃燒用CCA處理的木材中,直接或間接的攝取到燃燒CCA木材的灰燼造成了許多動物的死亡與一些人嚴重的中毒。人類的致死劑量約20 克的灰燼。一些建地或拆除地里的CCA木材可能不慎的被燃燒。廢棄的CCA木材的處理法並沒有全世界一致的標準,而有些人對現在通行的掩埋法有意見。
藥物
在18、19、20世紀,一部份的砷化合物被當作藥物使用,包括阿斯凡納明(被保羅·埃爾利希使用)與三氧化二砷(被湯瑪士·弗勒所使用)。 阿斯凡納明與新砷凡納明曾是梅毒與錐蟲病的藥方,但後來被抗生素所取代。 三氧化二砷500年被套用於各種領域,但最主要是用於治療癌症。在2000年,美國食品藥品監督管理局同意把此種化合物開給得急性早幼粒細胞白血病並對維A酸有抗藥性的病人。它也被弗勒用來治療牛皮癬。最近有針對砷-74(一個正子發射者)的研究,使用這種同位素的好處是,在正電子發射計算機斷層掃描時它的訊號比原先使用的碘-124清楚,因為碘傾向於往甲狀腺聚集,導致不少的噪聲 。
顏料
醋酸亞砷酸銅曾被用來當作綠色顏料,並有許多不同的俗名。包括'巴黎綠'與'寶石綠',它導致了不少的砷中毒。舍勒綠一種亞砷酸銅,曾在十九世紀用來當作在甜品內的食用色素。
軍事
一次世界大戰後,美國儲存了20,000 噸的路易氏劑,一種含砷的化學武器,是其中的糜爛劑並會刺激肺。這些存貨在1950年代後被用漂白劑無效化並被倒入墨西哥灣。
在越南戰爭期間,美軍曾使用藍色枯葉劑(二甲砷酸)作為彩虹除草劑的一種,防止北越得到珍貴的糧食作物。
其他用途
 殺蟲劑
殺蟲劑 在動物的飼料里,特別在美國是防治疾病 與刺激生長的一個方法。一個例子是在1995年至2000年,洛克沙砷曾占了嫩雞幼年與成長飼料中的69.8%與73.9%。
砷化鎵是一種重要的半導體材料,使用在積體電路中,使用這種材料的積體電路速度比用矽的快的多(但也比用矽的貴的多)。不像砷,它是使用直接遷移,所以可以用在雷射二極體與LED中,把電能直接轉成光能。在矽半導體中,砷也常被使用做為形成n型半導體時摻雜的元素之一。
也被用在表面鍍銅與煙火製造。
接近2%的砷被用來製造鉛合金,用於鉛彈與子彈。
少量的砷備加入黃銅,使之可以抵抗脫鋅,這種等級的黃銅被用來製造水管配線。
生理學特性
生物代謝
砷經由食入會吸收 60-90% 。經由吸入吸收 60-90% ,塵埃粒徑的大小會決定沉著的部位。而經由皮膚吸收的極少。砷在吸收之後會分布到肝、脾、腎、肺、消化道,然後在暴露後四周之後大概只在皮膚、頭髮、指甲、骨頭、牙齒還存有少量,其它的都會迅速地被排除掉。
在人體內,五價砷和三價砷會互相轉換,而也許代表去毒的甲基化則多半在肝臟進行。甲基化的能力會因砷暴露量增加而減低,然而,甲基化的能力是可以被訓練的,若長時間暴露低濃度的砷,則之後再暴露在高濃度砷時甲基化能力會增強。這接甲基化的砷會由腎臟、排汗、皮膚脫皮、或指甲頭髮等排除。而海產中的砷化物無法在人體內轉化而成,通常也以原貌由尿液排除。無機砷通常在兩天內排除,海產所含的砷化合物亦然。
生理功能
大量的羊、微型豬和雞的研究結果提出,砷是必需微量元素。飲料中含砷較低時(10~30mg/g),導致生長滯緩,懷孕減少,自發流產較多,死亡率較高。骨骼礦化減低,在羊和微型豬還觀察至心肌和骨骼肌纖維萎縮,線粒體膜有變化可破裂。砷在體內的生化功能還未確定,但研究提示砷可能在某些酶反應中起作用,以砷酸鹽替代磷酸鹽作為酶的激活劑,以亞砷酸鹽的形式與巰基反應作為酶抑制劑,從而可明顯影響某些酶的活性。有人觀察到,在做血透析的患者其血砷含量減少,並可能與患者中樞神經系統紊亂、血管疾病有關。
1、生理需要根據動物實驗資料提出,人的砷需要量為6.25μg/4.18MJ~12.5μg/4.18MJ,世界各地砷的攝入量一般為12~40μg,但攝入海產品多的人,砷的攝入量可達到每天195μg。
2、砷缺乏症在雛雞、倉鼠、山羊、豬和大白鼠實驗中,砷缺乏最一致的表現是生長抑制和生殖異常,後者的特徵是受精能力損傷和圍產期死亡率的增加。所有物種在缺砷時都表現出各種器官內礦物質含量的變化。對砷缺乏的某些應答反應取決於應激因子或其他因素的存在。
毒性
致毒砷化合物
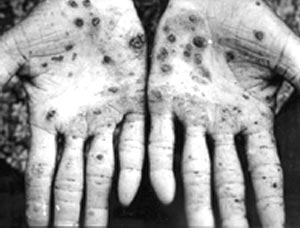 砷中毒表象
砷中毒表象 一般而言無機砷比有機砷要毒,三價砷比五價砷毒。三價砷會抑制含 -SH 的酵素,五價砷會在許多生化反應中與磷酸競爭,因為鍵結的不穩定,很快會水解而導致高能鍵 ( 如 ATP) 的消失。
砷化氫的毒性和其它的砷都不同,而它可說是目前已知的砷化合物中最毒的一個。自從半導體產業大量使用砷化鎵 (也用於雷射、光電產業) ,砷化氫的使用量也日漸增多。當酸或有還原能力的物質碰到含砷的其它物品就會產生砷化氫,即使該物品中含砷量不多。
氫化砷被吸入之後會很快與紅血球 結合併造成不可逆的細胞膜破壞。低濃度時氫化砷會造成溶血 ( 有劑量 - 反應關係 ) ,高濃度時則會造成多器官的細胞毒性。
毒理
砷與它的許多化合物為超強的毒藥,砷會經由許多機制干擾ATP的合成,在三羧酸循環中,砷會阻礙丙酮酸脫氫酶,並藉由與其競爭磷酸根來分離氧化磷酸化,造成與能量相關的煙醯胺腺嘌呤二核苷酸還原、粒線體呼吸作用與ATP合成被干擾。過氧化氫的生產量也會增加,可能會導致它產生出活性強的氧化合物與有氧化力的化合物。這些新陳代謝的干擾會由細胞壞死,非細胞凋亡導致多重器官衰竭導致死亡。解剖的話會發現許多磚紅色的黏膜,產生的原因是嚴重出血。雖然砷會導致中毒,但它也可以當作保護的角色 。
人體各系統毒理見砷中毒詞條。
中毒表現
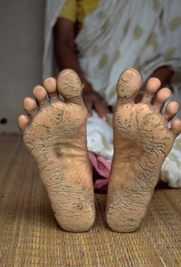 砷中毒
砷中毒 1、急性砷中毒
早期常見消化道症狀,如口及咽喉部有乾、痛、燒灼、緊縮感,聲嘶、噁心、嘔吐、咽下困難、腹痛和腹瀉等。嘔吐物先是胃內容物及米泔水樣,繼之混有血液、粘液和膽汁,有時雜有未吸收的砷化物小塊;嘔吐物可有蒜樣氣味。重症極似霍亂,開始排大量水樣糞便,以後變為血性,或為米泔水樣混有血絲,很快發生脫水、酸中毒以至休克。同時可有頭痛、眩暈、煩躁、譫妄、中毒性心肌炎、多發性神經炎等。少數有鼻衄及皮膚出血。嚴重者可於中毒後24小時至數日發生呼吸、循環、肝、腎等功能衰竭及中樞神經病變,出現呼吸困難、驚厥、昏迷等危重徵象,少數病人可在中毒後20分鐘至48小時內出現休克、甚至死亡,而胃腸道症狀並不顯著。病兒可有血卟啉病發作,尿卟膽原強陽性。
2、砷化氫中毒
常有溶血現象。
3、亞急性中毒
出現多發性神經炎的症狀,四肢感覺異常,先是疼痛、麻木,繼而無力、衰弱,直至完全麻痹或不全麻痹,出現腕垂、足垂及腱反射消失等;或有咽下困難,發音及呼吸障礙。由於血管舒縮功能障礙,有時發生皮膚潮紅或紅斑。
4、慢性砷中毒
多表現為衰弱,食欲不振,偶有噁心,嘔吐,便秘或腹瀉等。尚可出現白細胞和血小板減少,貧血,紅細胞和骨髓細胞生成障礙,脫髮,口炎,鼻炎,鼻中隔潰瘍、穿孔,皮膚色素沉著,可有剝脫性皮炎。手掌及足趾皮膚過度角化,指甲失去光澤和平整狀態,變薄且脆,出現白色橫紋,並有肝臟及心肌損害。中毒患者發砷、尿砷和指(趾)甲砷含量增高。口服大量砷的病兒,在作腹部X線檢查時,可發現其胃腸道中有X線不能穿透的物質。
接觸途徑
 養殖戶求賣相餵有機砷
養殖戶求賣相餵有機砷 砷出現在飲用水裡會導致砷中毒,其中最常見的是砷酸鹽[HAsO42− ; As(V)]與亞砷酸[H3AsO3 ; As(III)]。砷有能力自由的在+3氧化態與+5氧化態來迴轉換,導致他在自然界中的來源更多。飲用水的污染曾在美國、德國、阿根廷、智利、台灣 ( 烏腳病 ) 、英國都有發生過 。
出現在地面水中的砷曾經造成孟加拉與鄰近國家的大規模砷中毒。全世界主要有42個發現地表水中含有砷的個案,估計有接近5700萬人飲用的地表水中所含的砷超過WHO所規定的10ppb標準。
2、生活或工作接觸
砷會成為惡名昭彰的毒素乃因為砷且容易接觸,在過去,就有小朋友誤食含砷的殺蟲劑,或是在經過砷化銅處理的木頭家具附近玩耍時,會因皮膚接觸或食入導致砷中毒。
使用無機砷與其化合物的工廠如木材處理工廠、玻璃製造工廠、不含鐵的金屬合金與半導體製造。無機砷也在焦爐的殘餘物中被偵測出來。工作中的接觸與中毒可能會出現在這些工廠上班的人身上。
急救措施
急性暴露 :送到醫院前應確保病人呼吸到暢通且有呼吸及脈搏,並與就近的毒理單位聯絡。
若是皮膚暴露就要衝洗,但是對小孩或老人要注意不可造成失溫。
若是眼睛暴露也是用水沖洗至少15分鐘,假如可以的話應該移除隱形眼鏡。
若食入大量砷,在食入一小時內給予活性碳 (1mg/Kg ,大人通常為 60-90mg ,小朋友通常是 25-50mg) 最有效,若沒有嘔吐也可以洗胃,此時必須確定病人意識清醒且要注意呼吸到的暢通,避免嘔吐及吸入呼吸道。因為體液的大量流失,有症狀的病人必須要從靜脈補充並以機器監視心臟節律,就算是沒有低血壓症狀的病人也應補充水分,並且我們要紀錄尿量已評估體意補充的情形,若有需要,病人應送入加護病房隨時補充體液,若有腎衰竭應接受透析治療。
可以考慮螯合治療的藥物DMSA(dimercaptosuccinic acid) (口服),建議使用劑量為每八小時 10 μ g/Kg 或是 350mg/m2 給五天,之後每十二小時給 10 μ g/Kg 給 14 天。至於口服 D-penicillamine 雖然有報告對小孩子的急性砷中毒有效,但是對實驗動物卻沒有效果。
慢性暴露:找出砷暴露的來源並避免進一步的暴露,有研究顯示曾暴露砷的小孩在離開暴露源之後曾經升高的尿中砷就逐漸下降。砷引起的周邊神經病變要耗時數月恢復,且少有恢復完全。
安全標準
在歐盟,en:directive 67/548/EEC將元素砷與其化合物被歸類於"有毒的"與"對環境有危害的" 國際癌症研究機構(IARC)將砷與其化合物歸類於第一類致癌物質,而歐盟也將三氧化二砷、五氧化二砷與砷酸鹽歸類於第一類致癌物質 。
生命元素
化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||

