概述
 鑥
鑥鑥為銀白色金屬,是稀土元素中最硬和最緻密的金屬;熔點1663°C,沸點3395°C,密度9.8404。鑥在空氣中比較穩定;氧化鑥為無色晶體,溶於酸生成相應的無色鹽。鑥主要用於研究工作,其它用途很少。質軟。溶於稀酸,能與水緩慢作用。鹽類無色,氧化物白色。天然存在的同位素有:175Lu和半衰期為2.1×1010年的β發射體176Lu。自然界儲量極少,價格較貴,由氟化鑥LuF3•2H2O用鈣還原而製得,用於原子能工業。
綜合性質
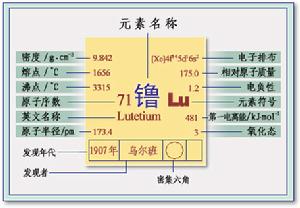
元素名稱:鑥
元素原子量:175.0
體積彈性模量:Gpa:47.6
原子化焓:kJ /mol @25℃:98
熱容:J /(mol• K):6.86
導電性:10^6/(cm •Ω ):0.0185
導熱係數:W/(m•K):6.4
熔化熱:(千焦/摩爾):18.60
汽化熱:(千焦/摩爾):355.90
 鑥
鑥元素在宇宙中的含量:(ppm):0.00001
元素在太陽中的含量:(ppm):0.001
元素在海水中的含量:(ppm):大西洋表面 0.00000014
氧化態:Main Lu+3
Other
地殼中含量:(ppm):0.51
晶體結構:晶胞為六方晶胞。
晶胞參數:
a = 350.31 pm
b = 350.31 pm
c = 555.09 pm
α = 90°
β = 90°
γ = 120°
維氏硬度:1160MPa
電離能 (kJ /mol)
M - M+ 523.5
M+ - M2+ 1340
M2+ - M3+ 2022
M3+ - M4+ 4360
相對原子質量:174.96
 元素周期表·鑥
元素周期表·鑥電負性: 1
外圍電子排布:4f14 5d1 6s2
核外電子排布: 2,8,18,32,9,2
同位素及放射線:Lu-172[6.7d] Lu-173[1.37y] Lu-174[3.3y]s *Lu-175 Lu-176(放 β[3.6E10y]) Lu-177[6.68d]
電子親合和能:0 KJ•mol-1
第一電離能:523.5 KJ•mol-1
第二電離能: 1340 KJ•mol-1
第三電離能: 0 KJ•mol-1
單質密度: 9.85 g/cm3
單質熔點: 1656.0 ℃
單質沸點: 3315.0 ℃
原子半徑: 2.25 埃
離子半徑: 0.98(+3) 埃
共價半徑: 1.56 埃
特性
 醋酸鑥
醋酸鑥發現
發現人:烏爾班(G.Urbain) 發現年代:1906年
發現過程:1906年由烏爾班(G.Urbain)發現的。
稀土元素的發現從18世紀末到20世紀初,經歷了100多年,發現了數十個,但只肯定了其中的十幾個。鑥是20世紀初發現並肯定的稀土元素。這是1907年法國化學家烏爾班從鐿中分離出來的。鑥的拉丁名稱來自法國巴黎的古名,是烏爾班的出生地。鑥和另一個稀土元素銪的發現就完成了自然界中存在的所有稀土元素的發現。它們倆的發現可以認為是打開了稀土元素髮現的第四座大門,完成了稀土元素髮現的第四階段。
研究過程
鑥是稀土金屬之一。稀土是歷史遺留的名稱,從18世紀末葉開始被陸續發現。當時人們慣於把不溶於水的固體氧化物稱作土,例如把氧化鋁叫做陶土,氧化鎂叫苦土。稀土是以氧化物狀態分離出來,很稀少,因而得名稀土,稀土元素的原子序數是21(Sc)、39(Y)、57(La)至71(Lu)。它們的化學性質很相似,這是由於核外電子結構特點所決定的。它們一般均生成三價化合物。鈧的化
 稀土-氧化鑥
稀土-氧化鑥學性質與其它稀土差別明顯,一般稀土礦物中不含鈧。鉕是從鈾反應堆裂變產物中獲得,放射性元素147Pm半衰期2.7年。過去認為鉕在自然界中不存在,直到1965年,荷蘭的一個磷酸鹽工廠在處理磷灰石中,才發現了鉕的痕量成分。
因此中國1968年將鉕劃入64種有色金屬之外。 1787年瑞典人阿累尼斯(C.A.Arrhenius)在斯德哥爾摩(Stockholm)附近的伊特比(Ytterby)小鎮上尋得了一塊不尋常的黑色礦石,1794年芬蘭化學家加多林(J.Gadolin)研究了這種礦石,從其中分離出一種新物質,三年後(1797年),瑞典人愛克伯格(A.G.Ekeberg)證實了這一發現,並以發現地名給新的物質命名為Ytteia(釔土)。後來為了紀念加多林,稱這種礦石為Gadolinite(加多林礦,即矽鈹釔礦)。 1803年德國化學家克拉普羅茲(M.H.Klaproth)和瑞典化學家柏齊力阿斯(J.J.Berzelius)及希生格爾(W.Hisinger)同時分別從另一礦石(鈰矽礦)中發現了另一種新的物質---鈰土(Ceria)。1839年瑞典人莫桑得爾(C.G.Mosander)發現了鑭和鐠釹混合物(didymium)。
1885年奧地利人威斯巴克(A.V.Welsbach)從莫桑得爾認為是“新元素”的鐠釹混合物中發現了鐠和釹。1879年法國人布瓦普德朗(L.D.Boisbauder)發現了釤。1901年法國人德馬爾賽(E.A.Demarcay)發現了銪。1880年瑞士馬利納克(J.C.G.De Marignac)發現了釓。1843年莫桑得爾發現了鋱和鉺。1886年布瓦普德朗發現了鏑。1879年瑞典人克利夫(P.T.Cleve)發現了鈥和銩。1974年美國人馬瑞斯克(J.A.Marisky)等從鈾裂產物中得到鉕。1879年瑞典人尼爾松(L.F.Nilson)發現了鈧。從1794年加多林分離出釔土至1947年製得鉕,歷時150多年。
鑥的稀土金屬是光澤介於銀和鐵之間。雜質含量對它們的性質影響很大,因而載於文獻中物理性質常有明顯差異。鑭在6°K時是超導體。大多數稀土金屬呈現順磁性,釓在0℃時比鐵具有更強的鐵磁性。鋱、鏑、鈥、鉺等在低溫下也呈現鐵磁性。鑭、鈰的低熔點和釤、銪、鐿的高蒸氣壓表現出稀土金屬的物理性質有極大差異。釤、銪、釓的熱中子吸收截面比廣泛用於核反應堆控制材料的鎘、硼還大。稀土金屬具有可塑性,以釤和意為最好。除鐿外,釔組稀土較鈰組稀土具有更高的硬度。
稀土金屬的化學活性很強。當和氧作用時,生成穩定性很高的R2O3型氧化物(R表示稀土金屬)。鈰、鐠、鋱還生成CeO2、Pr6O11、TbO2型氧化物。它們的標準生成熱和標準自由焓負值比鈣、鋁、鎂氧化物的值還大。稀土氧化物的熔點在2000℃以上,銪的原子半徑最大,性質最活潑,在室溫下暴露於空氣中立即失去光澤,很快氧化成粉末。鑭、鈰是、鐠、釹也易於氧化,在表面生成氧化物薄膜。金屬釔、釓、鑥的抗腐蝕性強,能較長時間地保持其金屬光澤。稀土金屬能以不同速率與水反應。銪與冷水劇烈反應釋放出氫。鈰組稀土金屬在室溫下與水反應緩慢,溫度增高則反應加快。釔組稀土金屬則較為穩定。稀土金屬在高溫下與鹵素反應生成+2、+3、+4價的鹵化物。無水鹵化物吸水性很強,很容易水解生成ROX(X表示鹵素)型鹵氧化合物。稀土金屬還能和硼、碳、硫、氫、氮反應生成相應的化合物。資源
目前世界上已知的稀土礦物及含有稀土元素的礦物有250多種,稀土元素含量較高的礦物有60多種,有工業價值的不到10種。中國稀土資源極其豐富,其特點可概括為:儲量大、品種全、有價值的元素含量高、分布廣。中國稀土的工業儲量(按氧化物計)是國外稀土工業儲量的2.2倍。國外稀土資源集中在美國、印度、巴西、澳大利亞和蘇聯等國,工業儲量(按氧化物計)為701.11萬噸。
用途
 鑥
鑥稀土拋光粉用於各種玻璃器件的拋光。單一的高純稀土氧化物用於合成各種螢光體,如彩色電視紅色螢光粉、投影電視白色螢光粉等螢光材料。稀土金屬碘化物用於製造金屬鹵素燈,代替碳精棒電弧燈作照明光源。用稀土金屬製備的稀土—鈷硬磁合金,具有高剩磁、高矯頑力的優點。釔鐵石榴石鐵氧體是用高純Y2O3和氧化鐵製成單晶或多晶的鐵磁材料。它們用於微波器件。高純Gd2O3用於製備釔鎵石榴石,它的單晶用作磁泡的基片。金屬鑭和鎳製成的LaNi5貯氫材料,吸氫和放氫速度快,每摩爾LaNi5可貯存6.5—6.7摩爾氫。在原子能工業中,利用銪和釓的同位素的中子吸收截面大的特性,作輕水堆和快中子增殖堆的控制棒和中子吸收劑。稀土元素作為微量化肥,對農作物有增產效果。打火石是稀土發火合金的傳統用途,目前仍是鈰組稀土金屬的重要用途。
注意事項
像其他稀土金屬中鑥被認為是低程度的毒性,但它的化合物應小心處理,例如氟鑥吸入是很危險的和化合物易刺激皮膚。硝酸鑥也是危險的因為它可能會發生爆炸和燃燒。氧化物鑥粉末是有毒物質,如果經吸入或食入會很危險。鑥鹽與其他3組的元素和鑭系元素反應,鑥已知沒有生物學作用,但它發現在人類里,主要集中在骨骼中,並較小程度影響在肝臟和腎臟。人類飲食沒有控制鑥多寡,所以不知道鑥鹽已發生與其他稀土鹽;所有鑭系元素在人體內的含量最少。人類的平均需要多少,但估計量是每年大約要有幾個微克,都來自微量的植物。可溶性鑥鹽是溫和毒性,但為不溶性。化學元素周期表
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | |
| 周期↓ | I A | 0 | |||||||||||||||||||
| 1 | 1 H 氫 | 2 He 氦 | K | 2 | |||||||||||||||||
| II A | III A | IV A | V A | VI A | VII A | ||||||||||||||||
| 2 | 3 Li 鋰 | 4 Be 鈹 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 | L K | 8 2 | |||||||||||
| 3 | 11 Na 鈉 | 12 Mg 鎂 | 13 Al 鋁 | 14 Si 矽 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氬 | M L K | 8 8 2 | |||||||||||
| III B | IV B | V B | VI B | VII B | VIII | I B | II B | ||||||||||||||
| 4 | 19 K 鉀 | 20 Ca 鈣 | 21 Sc 鈧 | 22 Ti 鈦 | 23 V 釩 | 24 Cr 鉻 | 25 Mn 錳 | 26 Fe 鐵 | 27 Co 鈷 | 28 Ni 鎳 | 29 Cu 銅 | 30 Zn 鋅 | 31 Ga 鎵 | 32 Ge 鍺 | 33 As 砷 | 34 Se 硒 | 35 Br 溴 | 36 Kr 氪 | N M L K | 8 18 8 2 | |
| 5 | 37 Rb 銣 | 38 Sr 鍶 | 39 Y 釔 | 40 Zr 鋯 | 41 Nb 鈮 | 42 Mo 鉬 | 43 Tc 鎝 | 44 Ru 釕 | 45 Rh 銠 | 46 Pd 鈀 | 47 Ag 銀 | 48 Cd 鎘 | 49 In 銦 | 50 Sn 錫 | 51 Sb 銻 | 52 Te 碲 | 53 I 碘 | 54 Xe 氙 | O N M L K | 8 18 18 8 2 | |
| 6 | 55 Cs 銫 | 56 Ba 鋇 | 57- 71 鑭系 | 72 Hf 鉿 | 73 Ta 鉭 | 74 W 鎢 | 75 Re 錸 | 76 Os 鋨 | 77 Ir 銥 | 78 Pt 鉑 | 79 Au 金 | 80 Hg 汞 | 81 Tl 鉈 | 82 Pb 鉛 | 83 Bi 鉍 | 84 Po 釙 | 85 At 砹 | 86 Rn 氡 | P O N M L K | 8 18 32 18 8 2 | |
| 7 | 87 Fr 鍅 | 88 Ra 鐳 | 89- 103 錒 | 104 Rf 鑪 | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds 鐽 | 111 Rg 錀 | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |||
| 鑭系元 素 | 57 La 鑭 | 58 Ce 鈰 | 59 Pr 鐠 | 60 Nd 釹 | 61 Pm 鉕 | 62 Sm 釤 | 63 Eu 銪 | 64 Gd 釓 | 65 Tb 鋱 | 66 Dy 鏑 | 67 Ho 鈥 | 68 Er 鉺 | 69 Tm 銩 | 70 Yb 鐿 | 71 Lu 鑥 | ||||||
| 錒系元 素 | 89 Ac 錒 | 90 Th 釷 | 91 Pa 鏷 | 92 U 鈾 | 93 Np 鎿 | 94 Pu 鈽 | 95 Am 鎇 | 96 Cm 鋦 | 97 Bk 錇 | 98 Cf 鐦 | 99 Es 鑀 | 100 Fm 鐨 | 101 Md 鍆 | 102 No 鍩 | 103 Lr 鐒 | ||||||
拼音是lu的漢字
| 拼音是lu的漢字共有160個,如下: |
| 慮|蘆|盧|碌|陸|露|路|錄|鹿|爐|魯|鹵|顱|廬|擄|綠|虜|賂|戮|潞|祿|麓|鱸|櫨|淥|瀘|轤|氌|簏|櫓|壚|臚|嚕|鑥|轆|漉|擼|璐|鸕|鷺|艫|侓|勎|勠|嚕|嚧|圥|坴|塶|塷|壚|娽|峍|廘|廬|彔|挔|捋|捛|攄|摝|擄|擼|攄|攎|枦|椂|樐|櫓|櫨|氌|淕|淥|濾|滷|瀂|濾|瀂|瀘|爐|獹|玈|琭|瓐|甪|盝|睩|矑|硉|磠|磠|祿|稑|籙|簬|簵|簶|籙|籚|粶|緑|纑|罏|膟|臚|舮|艣|艪|艫|菉|蓾|蕗|蘆|虂|虜|螰|蠦|觮|賂|趢|踛|蹗|轆|轤|醁|鈩|錄|録|錴|鏀|鏴|鐪|鑥|鑪|顱|騄|騼|髗|魯|魲|鯥|鱸|鴼|鵦|鵱|鷺|鸕|鹵|黸|率|鋁|驢|旅|屢|呂|律|氯|縷|侶|履 |

