概述
 原子
原子近代原子概念是在1803年由英國J.道爾頓提出的,主要內容有3點:
1.一切化學元素都是由不能再分割、不能毀滅的微粒組成的,這種微粒稱為原子。
2.同一種元素的原子的性質和 質量都相同 , 不同元素的原子的性質和質 量都不同。
3.兩種不同元素的化合作用是一種元素的一定數目的原子與另一種元素的一定數目的原子結合而形成化合物的各個分子。
自從放射性元素發現以後,原子是可以蛻變和分裂的,因此,道爾頓關於原子不可分割的說法應該加以修正,只能說在普通的化學反應中,原子不可分。同位素的發現也改變了同一種元素的原子的性質和重量都相同的說法,因為同一種元素的各種同位素的質量是不同的。1913年英國 H.G.J. 莫塞萊提出原子序數概念,指出同一種元素的各原子的質量可能不等,由此可見,一種元素所有的原子的基本特徵仍是原子序數。
定義
化學變化中的最小微粒
物理中物質構成的最基本粒子
性質
①原子的質量非常小
②不停地作無規則運動
③原子間有間隔
④同種原子性質相同,不同種原子性質不相同
特點
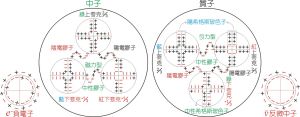 原子組成含:核子(質子,中子),電子,並隱含中微子
原子組成含:核子(質子,中子),電子,並隱含中微子原子,是化學元素最小組成單元,是組成分子和物質的基本單元,它具有該元素的化學性質。原子由帶正電荷的原子核和在原子核的庫侖場中運動的帶負電的電子組成。核電荷數或原子序數Z,是組成原子核的質子數。原子是非常微小的粒子。假設原子是球體的話,典型原子的直徑大約是10-8厘米, 質量大約是10-23克。原子的概念最初是由英國化學家約翰?道爾頓提出的。1803年他發表“原子說”,提出所有物質都是由原子構成。
構成
原子的中心是一個微小的由核子(質子和中子)組成的原子核,占據了整個原子的絕大部分質量。原子核中的質子和中子緊密地堆在一起,因此原子核的密度很大。質子和中子的質量大至相等,中子略高一些。質子帶正電荷,中子不帶電荷,是電中性的。所以整個原子核是帶正電荷的。原子核即使和原子相比,還是非常細小的——比原子要小100,000倍。原子的大小主要是由最外電子層的大小所決定的。如有原子是一個足球場,那原子核就是場中央的一顆綠豆。所以原子幾乎是空的,被電子占據著。
性質
 某些原子核固有的核特徵
某些原子核固有的核特徵電子是帶負電荷的。它們遠比質子和中子輕,質量只有質子的約1/1836。它們高速地圍著原子核運轉。電子圍繞原子核的軌道並不都一樣。
在一顆電中性的原子中,質子和電子的數目是一樣的。另一方面,中子的數目不一定等於質子的數目。帶電荷的原子叫離子。電子數目比質子小的原子帶正電荷,叫陽離子。相反的原子帶負電荷,叫陰離子。金屬元素最外層電子一般小於四個,在反應中易失去電子,趨向達到穩定的結構,成為陽離子,非金屬元素最外層電子一般多於四個,在化學反應中易得到電子,趨向達到穩定的結構,成為陰離子。
原子序決定了該原子是那個族或那類元素。例如,碳原子是那些有6顆質子的原子。所有相同原子序的原子在很多物理性質都是一樣的,所顯示的化學反應都一樣。質子和中子數目的總和叫質量數。
只有94種原子是天然存在的每種原子都有一個名稱,每個名稱都有一個縮寫。俄國化學家門捷列夫根據不同原子的化學性質將它們排列在一張表中,這就是元素周期表。為紀念門捷列夫,第101號元素被命名為鍆。首11種原子(或元素)依次為氫、氦、鋰、鈹、硼、碳、氮、氧、氟、氖 和 鈉。它們的簡寫是H、He、Li、Be、B、C、N、O、F、Ne、Na。
發展史
早期歷史
關於物質是由離散單元組成且能夠被任意分割的概念流傳了上千年,但這些想法只是基於抽象的、哲學的推理,而非實驗和實驗觀察。隨著時間的推移以及文化及學派的轉變,哲學上原子的性質也有著很大的改變,而這種改變往往還帶有一些精神因素。儘管如此,對於原子的基本概念在數千年後仍然被化學家們採用,因為它能夠很簡明地闡述一些化學界的現象。原子論是元素派學說中最簡明、最具科學性的一種理論形態。英國自然科學史家丹皮爾認為,原子論在科學上
“要比它以前或以後的任何學說都更接近於現代觀點”。原子論的創始人是古希臘人留基伯(公元前500—約公元前440年),他是德謨克利特的老師。古代學者在論及原子論時,通常是把他們倆人的學說混在一起的。留基伯的學說由他的學生德謨克利特發展和完善,因此德謨克利特被公認為原子論的主要代表。
德謨克利特認為,萬物的本原或根本元素是“原子”和“虛空”。“原子”在希臘文中是“不可分”的意思。德謨克利特用這一概念來指稱構成具體事物的最基本的物質微粒。原子的根本特性是“充滿和堅實”,即原子內部沒有空隙,是堅固的、不可入的,因而是不可分的。德謨克利特認為,原子是永恆的、不生不滅的;原子在數量上是無限的;原子處在不斷的運動狀態中,它的惟一的運動形式是“振動”;原子的體積微小,是眼睛看不見的,即不能為感官所知覺,只能通過理性才能認識。
經過二十幾個世紀的探索,科學家在17世紀~18世紀通過實驗,證實了原子的真實存在。19世紀初英國化學家J.道爾頓在進一步總結前人經驗的基礎上,提出了具有近代意義的原子學說。這種原子學說的提出開創了化學的新時代,他解釋了很多物理、化學現象。
原子是一種元素能保持其化學性質的最小單位。一個原子包含有一個緻密的原子核及若干圍繞在原子核周圍帶負電的電子。原子核由帶正電的質子和電中性的中子組成。原子是化學變化的最小粒子,分子是由原子組成的,許多物質是由原子直接構成的
原子的英文名是從希臘語轉化而來,原意為不可切分的。很早以前,希臘和印度的哲學家就提出了原子的不可切分的概念。17和18世紀時,化學家發現了物理學的根據:對於某些物質,不能通過化學手段將其繼續的分解。19世紀晚期和20世紀早期,物理學家發現了亞原子粒子以及原子的內部結構,由此證明原子並不是不能進一步切分。量子力學原理能夠為原子提供很好的模型。
近代史
1661年,自然哲學家羅伯特·波義耳出版了《懷疑的化學家》(TheScepticalChemist)一書,他認為物質是由不同的“微粒”或原子自由組合構成的,而並不是由諸如氣、土、火、水等基本元素構成。恩格斯認為,波義耳是最早把化學確立為科學的化學家。
1789年,法國貴族,拉瓦錫定義了原子一詞,從此,原子就用來表示化學變化中的最小的單位。
1803年,英語教師及自然哲學家約翰·道爾頓(JohnDalton)用原子的概念解釋了為什麼不同元素總是呈整數倍反應,即倍比定律(lawofmultipleproportions);也解釋了為什麼某些氣體比另外一些更容易溶於水。他提出每一種元素只包含唯一一種原子,而這些原子相互結合起來就形成了化合物。
1827年,英國植物學家羅伯特·布朗(BotanistRobertBrown)在使用顯微鏡觀察水面上灰塵的時候,發現它們進行著不規則運動,進一步證明了微粒學說。後來,這一現象被稱為為布朗運動。
1877年,德紹爾克思(J.Desaulx)提出布朗運動是由於水分子的熱運動而導致的。
1897年,在關於陰極射線的工作中,物理學家約瑟夫·湯姆生(J.J.Thomsom)發現了電子以及它的亞原子特性,粉碎了一直以來認為原子不可再分的構想。湯姆生認為電子是平均的分布在整個原子上的,就如同散布在一個均勻的正電荷的海洋之中,它們的負電荷與那些正電荷相互抵消。這也叫做葡萄乾蛋糕模型(棗核模型)。
1905年,愛因斯坦提出了第一個數學分析的方法,證明了德紹爾克思的猜想。
1909年,在物理學家歐內斯特·盧瑟福(ErnestRutherford)的指導下,菲利普·倫納德(P.E.A.Lenard)用氦離子轟擊金箔。發現有很小一部分離子的偏轉角度遠遠大於使用湯姆生假設所預測值。盧瑟福根據這個金鉑實驗的結果指出:原子中大部分質量和正電荷都集中在位於原子中心的原子核當中,電子則像行星圍繞太陽一樣圍繞著原子核。帶正電的氦離子在穿越原子核附近時,就會被大角度的反射。這就是原子核的核式結構。
1913年,在進行有關對放射性衰變產物的實驗中,放射化學家弗雷德里克·索迪(FrederickSoddy)發現對於元素周期表中的每個位置,往往存在不只一種質量數的原子。瑪格麗特·陶德創造了同位素一詞,來表示同一種元素中不同種類的原子。在進行關於離子氣體的研究過程中,湯姆生髮明了一種新技術,可以用來分離不同的同位素,最終導致了穩定同位素的發現[;同年,物理學家尼爾斯·玻爾(NielsBohr)重新省視了盧瑟福的模型,並將其與普朗克及愛因斯坦的量子化思想聯繫起來,他認為電子應該位於原子內確定的軌道之中,並且能夠在不同軌道之間躍遷,而不是像先前認為那樣可以自由的向內或向外移動。電子在這些固定軌道間躍遷時,必須吸收或者釋放特定的能量。這種電子躍遷的理論能夠很好的解釋氫原子光譜中存在的固定位置的線條,並將普朗克常數與氫原子光譜的里德伯常量取得了聯繫。
1916年,德國化學家柯塞爾(Kossel)在考察大量事實後得出結論:任何元素的原子都要使最外層滿足8電子穩定結構。路易士發現化學鍵的本質就是兩個原子間電子的相互作用
1919年,物理學家盧瑟福在α粒子(氦原子核)轟擊氮原子的實驗中發現質子。弗朗西斯·威廉·阿斯頓(FrancisWilliamAston)使用質譜證實了同位素有著不同的質量,並且同位素間的質量差都為一個整數,這被稱為整數規則。美國化學家歐文·朗繆爾提出原子中的電子以某種性質相互連線或者說相互聚集。一組電子占有一個特定的電子層。
1923年,美國化學家吉爾伯特·牛頓·路易斯(G.N.Lewis)發展了柯賽爾的理論,提出共價鍵的電子對理論[7]。路易斯假設:在分子中來自於一個原子的一個電子與另一個原子的一個電子以“電子對”的形式形成原子間的化學鍵。這在當時是一個有悖於正統理論的假設,因為庫侖定律表明,兩個電子間是相互排斥的,但路易斯這種構想很快就為化學界所接受,並導致原子間電子自鏇相反假設的提出。
1926年,薛丁格(ErwinSchrödinger)使用路易斯·德布羅意(LouisdeBroglie)於1924年提出的波粒二象性的假說,建立了一個原子的數學模型,用來將電子描述為一個三維波形。但是在數學上不能夠同時得到位置和動量的精確值。沃納·海森堡(WernerHeisenberg)提出了著名的測不準原理。這個概念描述的是,對於測量的某個位置,只能得到一個不確定的動量範圍,反之亦然。儘管這個模型很難想像,但它能夠解釋一些以前觀測到卻不能解釋的原子的性質,例如比氫更大的原子的譜線。因此,人們不再使用玻爾的原子模型,而是將原子軌道視為電子高機率出現的區域(電子云)。質譜的發明使得科學家可以直接測量原子的準確質量。該設備通過使用一個磁體來曲一束離子,而偏轉量取決於原子的質荷比。弗朗西斯·阿斯頓使用質譜證實了同位素有著不同的質量,並且同位素間的質量差都為一個整數,這被稱為整數規則。
1930年,科學家發現,α射線轟擊鈹-9時,會產生一種電中性,擁有極強穿透力的射線,最初,這被認為是γ射線。
1932年,約里奧·居里夫婦發現,這種射線能從石蠟中打出質子;同年,盧瑟福的學生詹姆斯·查得威克(JamesChadwick)認定這就是中子,而同位素則被重新定義為有著相同質子數與不同中子數的元素。
1950年,隨著粒子加速器及粒子探測器的發展,科學家們可以研究高能粒子間的碰撞。他們發現中子和質子是強子的一種,由更小的夸克微粒構成。核物理的標準模型也隨之發展,能夠成功的在亞原子水平解釋整個原子核以及亞原子粒子之間的相互作用。
1985年,朱棣文及其同事在貝爾實驗室開發了一種新技術,能夠使用雷射來冷卻原子。威廉·丹尼爾·菲利普斯團隊設法將納原子置於一個磁阱中。這兩個技術加上由克洛德·科昂-唐努德日團隊基於都卜勒效應開發的一種方法,可以將少量的原子冷卻至微開爾文的溫度範圍,這樣就可以對原子進行很高精度的研究,為玻色-愛因斯坦凝聚的發現奠定了基礎。
歷史上,因為單個原子過於微小,被認為不能夠進行科學研究。2012年,科學家已經成功使用一單個金屬原子與一個有機配體連線形成一個單電子電晶體。在一些實驗中,通過雷射冷卻的方法將原子減速並捕獲,這些實驗能夠帶來對於物質更好的理解。
發展史
道爾頓的原子模型
英國自然科學家約翰·道爾頓將古希臘思辨的原子論改造成定量的化學理論,提出了世界上第一個原子的理論模型。他的理論主要有以下四點:
①所有物質都是由非常微小的、不可再分的物質微粒即原子組成
②同種元素的原子的各種性質和質量都相同,不同元素的原子,主要表現為質量的不同
③原子是微小的、不可再分的實心球體
④原子是參加化學變化的最小單位,在化學反應中,原子僅僅是重新排列,而不會被創造或者消失。
雖然,經過後人證實,這是一個失敗的理論模型,但道爾頓第一次將原子從哲學帶入化學研究中,明確了今後化學家們努力的方向,化學真正從古老的鍊金術中擺脫出來,道爾頓也因此被後人譽為“近代化學之父”。
葡萄乾布丁模型(棗核模型)
葡萄乾布丁模型(棗核模型)由湯姆生提出,是第一個存在著亞原子結構的原子模型。
湯姆生在發現電子的基礎上提出了原子的葡萄乾布丁模型(棗核模型),湯姆生認為:
①正電荷像流體一樣均勻分布在原子中,電子就像葡萄乾一樣散布在正電荷中,它們的負電荷與那些正電荷相互抵消
②在受到激發時,電子會離開原子,產生陰極射線。
湯姆生的學生盧瑟福完成的α粒子轟擊金箔實驗(散射實驗),否認了葡萄乾布丁模型(棗核模型)的正確性。
土星模型
在湯姆生提出葡萄乾布丁模型同年,日本科學家提出了土星模型,認為電子並不是均勻分布,而是集中分布在原子核外圍的一個固定軌道上。
行星模型
行星模型由盧瑟福在提出,以經典電磁學為理論基礎,主要內容有:
①原子的大部分體積是空的;
②在原子的中心有一個體積很小、密度極大的原子核;
③原子的全部正電荷在原子核內,且幾乎全部質量均集中在原子核內部。帶負電的電子在核空間進行高速的繞核運動。
隨著科學的進步,氫原子線狀光譜的事實表明行星模型是不正確的。
玻爾的原子模型
為了解釋氫原子線狀光譜這一事實,盧瑟福的學生玻爾接受了普朗克的量子論和愛因斯坦的光子概念在行星模型的基礎上提出了核外電子分層排布的原子結構模型。玻爾原子結構模型的基本觀點是:
①原子中的電子在具有確定半徑的圓周軌道(orbit)上繞原子核運動,不輻射能量
②在不同軌道上運動的電子具有不同的能量(E),且能量是量子化的,軌道能量值依n(1,2,3,。..)的增大而升高,n稱為量子數。而不同的軌道則分別被命名為K(n=1)、L(n=2)、M(n=3)、N(n=4)、O(n=5)、P(n=6)、Q(n=7)。
③若且唯若電子從一個軌道躍遷到另一個軌道時,才會輻射或吸收能量。如果輻射或吸收的能量以光的形式表現並被記錄下來,就形成了光譜。
玻爾的原子模型很好的解釋了氫原子的線狀光譜,但對於更加複雜的光譜現象卻無能為力。
現代量子力學模型
物理學家德布羅意、薛丁格和海森堡等人,經過13年的艱苦論證,在現代量子力學模型在玻爾原子模型的基礎上很好地解釋了許多複雜的光譜現象,其核心是波動力學。在玻爾原子模型里,軌道只有一個量子數(主量子數),現代量子力學模型則引入了更多的量子數(quantumnumber)。
①主量子數(principalquantumnumber),主量子數決定不同的電子亞層,命名為K、L、M、N、O、P、Q
②角量子數(angularquantumnumber),角量子數決定不同的能級,符號“l”共n個值(1,2,3,...n-1),符號用s、p、d、f、g,表示對多電子原子來說,電子的運動狀態與l有關。
③磁量子數(magneticquantumnumber)磁量子數決定不同能級的軌道,符號“m”(見下文“磁矩”)。僅在外加磁場時有用。“n”“l”“m”三個量確定一個原子的運動狀態。
④自鏇磁量子數(spinm.q.n.)處於同一軌道的電子有兩種自鏇,即“↑↓”自鏇現象的實質還在探討當中。
歷史意義
 道爾頓
道爾頓要了解道爾頓的原子學說的提出,要溯源至古希臘時期的原子學說。古希臘的哲學家留基伯首先提出了關於原子的學說,後經他的學生德謨克利特的進一步 發展,形成了歐洲最早的樸素唯物主義的原子論,德謨克利特認為:宇宙萬物是由世界上最微小的、堅硬的、不可入、不可分的物質粒子構成的,他將這種粒叫作“原子”。他認為,原子在性質上相同,但在形狀大小上卻是多種多樣的。萬物之所以不同,就是由於萬物本身的原子在數目、形狀和排列上各有不同,就是由於萬物本身的原子在數目、形狀和排列上各有所不同。並且認為,原子總在不斷運動,運動是原子本身所因有的性質。無數的原子在空間中不斷運動、互相碰撞而形成世界及其中的事物。月、日、星辰是由原子構成的,甚至人的靈魂也是由原子構成的。由此可見,德謨克利特的原子論論證了世界的物質性,對自然界的本質提出了大膽而有創造性的臆測,比較深刻地說明了物質結構,肯定了運動是物質的屬性,因而具有重要的意義。
基本構成
亞原子粒子
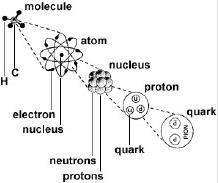 亞原子粒子
亞原子粒子儘管原子的英文名稱(atom)本意是不能被進一步分割的最小粒子,但是,隨著科學的發展,原子被認為是由電子、質子、中子(氫原子由質子和電子構成)構成,它們被統稱為亞原子粒子。幾乎所有原子都含有上述三種亞原子粒子,但氕(氫的同位素)沒有中子,其離子(失去電子後)只是一個質子。
質子帶有一個正電荷,質量是電子質量的1836倍,為1.6726×10^-27kg,然而部分質量可以轉化為原子結合能。中子不帶電荷,自由中子的質量是電子質量的1839倍,為1.6929×10^-27kg。中子和質子的尺寸相仿,均在2.5×10^-15m這一數量級,但它們的表面並沒能精確定義。
原子儘管很小,用化學方法不能再分,但用其他方法仍然可以再分,因為原子也有一定的構成。原子是由中心的帶正電的原子核和核外帶負電的電子構成的(反物質相反),原子核是由質子和中子兩種粒子構成的,電子在核外較大空間內做高速運動。
在物理學標準模型理論中,質子和中子都由名叫夸克的基本粒子構成。夸克是費米子的一種,也是構成物質的兩個基本組分之一。另外一個基本組份被稱作是輕子,電子就是輕子的一種。夸克共有六種,每一種都帶有分數的電荷,不是+2/3就是-1/3。質子就是由兩個上夸克和一個下夸克組成,而中子則是由一個上夸克和兩個下夸克組成。這個區別就解釋了為什麼中子和質子電荷和質量均有差別。夸克由強相互作用結合在一起的,由膠子作為中介。膠子是規範玻色子的一員,是一種用來傳遞力的基本粒子。
亞原子粒子具有量子化特徵和波粒二象性,公式表述為:λ=h/p=h/mv,式中λ為波長,p為動量,h為普朗克常數(6.626×10^-34J·S)。
電子
在一個內部接近真空、兩端封有金屬電極的玻璃管通上高壓直流電,陰極一端便會發出陰極射線。螢光屏可以顯示這種射線的方向,如果外加一個勻強電場,陰極射線會偏向陽極;又若在玻璃管內裝上轉輪,射線可以使轉輪轉動。後經證實,陰極射線是一群帶有負電荷的高速質點,即電子流。電子由此被發現。
電子是最早發現的亞原子粒子,到目前為止,電子是所有粒子中最輕的,只有kg,為氫原子的[1/1836.152701(37)],是密立根在1910年前後通過著名的“油滴實驗”做出的。電子帶有一個單位的負電荷,即4.8×10^-19靜電單位或1.6×10^-19庫倫,其體積因為過於微小,現有的技術已經無法測量。
現代物理學認為,電子屬於輕子的一種是構成物質的基本單位之一(另一種為夸克)。
電子云
 電子云
電子云電子具有波粒二象性,不能像描述普通物體運動那樣,肯定他在某一瞬間處於空間的某一點,而只能指出它在原子核外某處出現的可能性(即幾率)的大小。電子在原子核各處出現的幾率是不同的,有些地方出現的幾率大,
有些地方出現的幾率很小,如果將電子在核外各處出現的幾率用小黑點描繪出來(出現的幾率越大,小黑點越密),那么便得到一種略具直觀性的圖像,這些圖像中,原子核仿佛被帶負電荷的電子云物所籠罩,故稱電子云。
在一個原子中,電子和質子因為電磁力而相互吸引,也正是這個力將電子束縛在一個環繞著原子核的靜電位勢阱中,要從這個勢阱中逃逸則需要外部的能量。電子離原子核越近,吸引力則越大。因此,與外層電子相比,離核近的電子需要更多能量才能夠逃逸。
原子軌道則是一個描述了電子在核內的機率分布的數學方程。在實際中,只有一組離散的(或量子化的)軌道存在,其他可能的形式會很快的坍塌成一個更穩定的形式。這些軌道可以有一個或多個的環或節點,並且它們的大小,形狀和空間方向都有不同。
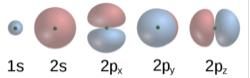 前五個原子軌道的波函式
前五個原子軌道的波函式每一個原子軌道都對應一個電子的能級。電子可以通過吸收一個帶有足夠能量的光子而躍遷到一個更高的能級。同樣的,通過自發輻射,在高能級態的電子也可以躍遷回一個低能級態,釋放出光子。這些典型的能量,也就是不同量子態之間的能量差,可以用來解釋原子譜線。
把核外電子出現幾率相等的地方連線起來,作為電子云的界面,使界面內電子云出現的總幾率很大(例如90%或95%),在界面外的幾率很小,有這個界面所包括的空間範圍,叫做原子軌道,這裡的原子軌道與巨觀的軌道具有不同的含義。
在原子核中除去或增加一個電子所需要的能量遠遠小於核子的結合能,這些能量被稱為電子結合能。例如:奪去氫原子中基態電子只需要13.6eV。當電子數與質子數相等時,原子是電中性的。如果電子數大於或小於質子數時,該原子就會被稱為離子。原子最外層電子可以移動至相鄰的原子,也可以由兩個原子所共有。正是由於有了這種機理,原子才能夠鍵合形成分子或其他種類的化合物,例如離子或共價的網狀晶體。
原子軌道是薛丁格方程的合理解,薛丁格方程為一個二階偏微方程
(^2ψ/x^2)+(^2ψ/y^2)+(^2ψ/z^2)=-(8π^2)/(h^2)·(E-V)ψ,
該方程的解ψ是x、y、z的函式,寫成ψ(x,y,z)。為了更形象地描述波函式的意義,通常用球坐標來描述波函式,即ψ(r,θ,φ)=R(r)·Y(θ,φ),這裡R(r)函式是與徑向分布有關的函式,稱為徑向分布函式;Y(θ,φ)是與角度分布有關的,稱為角度分布波函式。
原子核
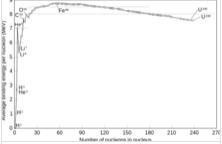 不同同位素中,將核子連在一起所需要的能量
不同同位素中,將核子連在一起所需要的能量原子中所有的質子和中子結合起來就形成了一個很小的原子核,它們一起也可以被稱為核子。原子核的半徑約等於fm其中A是核子的總數。原子半徑的數量級大約是105fm,因此原子核的半徑遠遠小於原子的半徑。核子被能在短距離上起作用的殘留強力束縛在一起。當距離小於2.5fm的時候,強力遠遠大於靜電力,因此它能夠克服帶正電的質子間的相互排斥。
同種元素的原子帶有相同數量的質子,這個數也被稱作原子序數。而對於某種特定的元素,中子數是可以變化的,這也就決定了該原子是這種元素的哪一種同位素。質子數量和中子數量決定了該原子是這種元素的哪一種核素。中子數決定了該原子的穩定程度,一些同位素能夠自發進行放射性衰變。
中子和質子都是費米子的一種,根據量子力學中的泡利不相容原理,不可能有完全相同的兩個費米子同時擁有一樣量子物理態。因此,原子核中的每一個質子都占用不同的能級,中子的情況也與此相同。不過泡利不相容原理並沒有禁止一個質子和一個中子擁有相同的量子態。
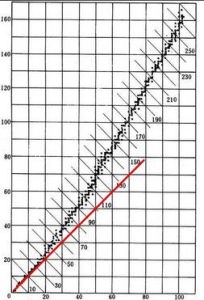 核素圖&
核素圖&如果一個原子核的質子數和中子數不相同,那么該原子核很容易發生放射性衰變到一個更低的能級,並且使得質子數和中子數更加相近。因此,質子數和中子數相同或很相近的原子更加不容易衰變。然而,當原子序數逐漸增加時,因為質子之間的排斥力增強,需要更多的中子來使整個原子核變的穩定,所以對上述趨勢有所影響。因此,當原子序數大於20時,就不能找到一個質子數與中子數相等而又穩定的原子核了。隨著Z的增加,中子和質子的比例逐漸趨於1.5。
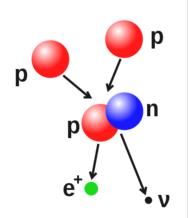
核聚變示意圖,圖中兩個質子聚變生成一個包含有一個質子和一個中子的氘原子核,並釋放出一個正電子(電子的反物質)以及一個電子中微子。
原子核中的質子數和中子數也是可以變化的,不過因為它們之間的力很強,所以需要很高的能量,當多個粒子聚集形成更重的原子核時,就會發生核聚變,例如兩個核之間的高能碰撞。在太陽的核心,質子需要3-10KeV的能量才能夠克服它們之間的相互排斥,也就是庫侖障壁,進而融合起來形成一個新的核。與此相反的過程是核裂變,在核裂變中,一個核通常是經過放射性衰變,分裂成為兩個更小的核。使用高能的亞原子粒子或光子轟擊也能夠改變原子核。如果在一個過程中,原子核中質子數發生了變化,則此原子就變成了另外一種元素的原子了。
 核聚變示意圖
核聚變示意圖如果核聚變後產生的原子核質量小於聚變前原子質量的總和,那么根據愛因斯坦的質能方程,這一些質量的差就作為能量被釋放了。這個差別實際是原子核之間的結合能。
對於兩個原子序數在鐵或鎳之前的原子核來說,它們之間的核聚變是一個放熱過程,也就是說過程釋放的能量大於將它們連在一起的能量。正是因為如此,才確保了恆星中的核聚變能夠自我維持。對於更重一些的原子來說,結合能開始減少,也就是說它們的核聚變會是一個吸熱過程。因此,這些更重的原子不能夠進行產能的核聚變,也就不能夠維持恆星的流體靜力平衡。
在α粒子散射實驗中,人們發現,原子的質量集中於一個很小且帶正電的物質中,這就是原子核。
原子核也稱作核子,由原子中所有的質子和中子組成,原子核的半徑約等於1.07×A^1/3fm,其中A是核子的總數。原子半徑的數量級大約是105fm,因此原子核的半徑遠遠小於原子的半徑。
組成
原子核由質子與中子組成(氫原子核只有一個質子),中子和質子都是費米子的一種,根據量子力學中的泡利不相容原理,不可能有完全相同的兩個費米子同時擁有一樣量子物理態。因此,原子核中的每一個質子都占用不同的能級,中子的情況也與此相同。不過泡利不相容原理並沒有禁止一個質子和一個中子擁有相同的量子態。
質子(proton)
不同同位素中,將核子連在一起所需要的能量
質子由兩個上夸克和一個下夸克組成,帶一個單位正電荷,質量是電子質量的1836.152701(37)倍,為1.6726231(10)×10–27kg,然而部分質量可以轉化為原子結合能。擁有相同質子數的原子是同一種元素,原子序數=質子數=核電荷數=核外電子數。
中子(neutron)
中子是原子中質量最大的亞原子粒子,自由中子的質量是電子質量的1838.683662(40)倍,為1.6749286(10)×10^-27kg。中子和質子的尺寸相仿,均在2.5×10^-15m這一數量級,但它們的表面並沒能精確定義。
中子由一個上夸克和兩個下夸克組成,兩種夸克的電荷相互抵銷,所以中子不顯電性,但,認為“中子不帶電”的觀點是錯誤的。
而對於某種特定的元素,中子數是可以變化的,擁有不同中子數的同種元素被稱為同位素。中子數決定了一個原子的穩定程度,一些元素的同位素能夠自發進行放射性衰變。
核力(nuclearforce)
原子核被一種強力束縛線上度為10^-15m的區域內。由於質子帶正電,根據庫侖定律,質子間的排斥作用本會使原子核爆裂,但,原子核中有一種力,把質子和中子緊緊束縛在一起,這種力就是核力。在一定距離內,核力遠遠大於靜電力,克服了帶正電的質子間的相互排斥。
核力的作用範圍被稱作力程,作用範圍在2.5fm左右,最多不超過3fm,即,不能從一個原子核延伸到另一個原子核,因此,核力屬於短程力。
核素(nuclide)
具有相同質子數和中子數的原子核稱為核素,而用x軸表示質子數;用y軸表示中子數所得到的圖像就被稱為核素圖,由圖可以發現,在x∈{0,1,2,3,…,20}時,核素圖上的函式近似y=x,但隨著質子數的增加,質子間的庫侖斥力明顯增強,原子核需要比往常更多的中子數維持原子核的未定,在x∈{21,22,23,…,112}時,函式近似為y=1.5x,中子數大於質子數。
結合能(energyofthenucleus)
在原子核中,將核子從原子核中分離做功消耗的能量,被稱為結合能。實驗發現,任一原子核的質量總是小於其組成核子的質量和(這一差值被稱為質量虧損),因此,結合能可以由愛因斯坦質能方程推算:
結合能=(原子核內所有質子、中子的靜止質量和-原子核靜止質量)×光速^2
平均結合能(bindinge.o.t.n)
核素圖
一個原子核中每個核子結合能的平均值被稱作平均結合能,計算公式為:
每個核子的平均結合能=總結合能÷核子數
平均結合能越大,原子核越難被分解成單個的核子。由右圖可以看出:
①重核的平均結合能比中核小,因此,它們容易發生裂變並放出能量
②輕核的平均結合能比稍重的核的平均結合能小,因此,當輕核發生聚變時會放出能量。
原子的范德華半徑是指在分子晶體中,分子間以范德華力結合,如稀有氣體相鄰兩原子核間距的一半。
原子核中的質子數和中子數也是可以變化的,不過因為它們之間的力很強,所以需要很高的能量,當多個粒子聚集形成更重的原子核時,就會發生核聚變,例如兩個核之間的高能碰撞。在太陽的核心,質子需要3-10KeV的能量才能夠克服它們之間的相互排斥,也就是庫侖障壁,進而融合起來形成一個新的核。與此相反的過程是核裂變,在核裂變中,一個核通常是經過放射性衰變,分裂成為兩個更小的核。使用高能的亞原子粒子或光子轟擊也能夠改變原子核。如果在一個過程中,原子核中質子數發生了變化,則此原子就變成了另外一種元素的原子了。
對於兩個原子序數在鐵或鎳之前的原子核來說,它們之間的核聚變是一個放熱過程,也就是說過程釋放的能量大於將它們連在一起的能量。正是因為如此,才確保了恆星中的核聚變能夠自我維持。對於更重一些的原子來說,結合能開始減少,也就是說它們的核聚變會是一個吸熱過程。因此,這些更重的原子不能夠進行產能的核聚變,也就不能夠維持恆星的流體靜力平衡。
性質
放射性
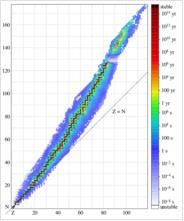 有Z個質子和N箇中子的同位素的半衰期
有Z個質子和N箇中子的同位素的半衰期每一種元素都有一個或多個同位素擁有不穩定的原子核,從而能發生放射性衰變,在這個過程中,原子核可以釋放出粒子或電磁輻射。當原子核的半徑大於強力的作用半徑時,放射性衰變就可能發生,而強力的作用半徑僅為幾飛米。
最常見的放射性衰變如下:
α衰變:原子核釋放一個α粒子,即含有兩個質子和兩個中子的氦原子核。衰變的結果是產生一個原子序數低一些的新元素。
β衰變:弱相互作用的現象,過程中一個中子轉變成一個質子或者一個質子轉變成一個中子。前者伴隨著一個電子和一個反中微子的釋放,後者則釋放一個正電子和一個中微子。所釋放的電子或正電子被叫做β粒子。因此,β衰變能夠使得該原子的原子序數增加或減少一。
γ衰變:原子核的能級降低,釋放出電磁波輻射,通常在釋放了α粒子或β粒子後發生。
其它比較罕見的放射性衰變還包括:釋放中子或質子,釋放核子團或電子團,通過內轉換產生高速的電子而非β射線以及高能的光子而非伽馬射線。
每一個放射性同位素都有一個特徵衰變期間,即半衰期。半衰期就是一半樣品發生衰變所需要的時間。這是一種指數衰變,即樣品在每一個半衰期內恆定的衰變50%,換句話說,當兩次半衰期之後,就只剩下25%的起始同位素了。
磁矩
基本微粒都有一個固有性質,就像在巨觀物理中圍繞質心鏇轉的物體都有角動量一樣,在量子力學中被叫做自鏇。但是嚴格來說,這些微粒僅僅是一些點,不能夠鏇轉。自鏇的單位是約化普朗克常數(),電子、質子和中子的自鏇都是½。在原子裡,電子圍繞原子核運動,所以除了自鏇,它們還有軌道角動量。而對於原子核來說,軌道角動量是起源於自身的自鏇。
正如一個鏇轉的帶電物體能夠產生磁場一樣,一個原子所產生的磁場,即它的磁矩,就是由這些不同的角動量決定的。然後,自鏇對它的影回響該是最大的。因為電子的一個性質就是要符合泡利不相容原理,即不能有兩個位於同樣量子態的電子,所以當電子成對時,總是一個自鏇朝上而另外一個自鏇朝下。這樣,它們產生的磁場相互抵消。對於某些帶有偶數個電子的原子,總的磁偶極矩會被減少至零。
對於鐵磁性的元素,例如鐵,因為電子總數為奇數,所以會產生一個淨磁矩。同時,因為相鄰原子軌道重疊等原因,當未成對電子都朝向同一個方向時,體系的總能量最低,這個過程被稱為交換相互作用。當這些鐵磁性元素的磁動量都統一朝向後,整個材料就會擁有一個巨觀可以測量的磁場。順磁性材料中,在沒有外部磁場的情況下,原子磁矩都是隨機分布的;施加了外部磁場以後,所有原子都會統一朝向,產生磁場。
原子核也可以存在淨自鏇。由於熱平衡,通常這些原子核都是隨機朝向的。但對於一些特定元素,例如氙-129,一部分核自鏇也是可能被極化的,這個狀態被叫做超極化,在核磁共振成像中有很重要的套用。
能級
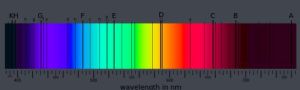 一個吸收譜線的例子:太陽的夫朗和斐譜線
一個吸收譜線的例子:太陽的夫朗和斐譜線原子中,電子的勢能與它離原子核的距離成反比。測量電子的勢能,通常的測量將讓該電子脫離原子所需要的能量,單位是電子伏特(eV)。在量子力學模型中,電子只能占據一組以原子核為中心的狀態,每一個狀態就對應於一個能級。最低的能級就被叫做基態,而更高的能級就被叫做激發態。
電子要在兩個能級之間躍遷的前提是它要吸收或者釋放能量,該能量還必須要和這兩個能級之間的能量差一致。因為釋放的光子能量只與光子的頻率有關,並且能級是不連續的,所以在電磁波譜中就會出現一些不連續的帶。每一個元素都有一個特徵波譜,特徵波譜取決於核電荷的多少,電子的填充情況,電子間的電磁相互作用以及一些其他的因素。
當一束全譜的光經過一團氣體或者一團等離子體後,一些光子會被原子吸收,使得這些原子內的電子躍遷。而在激發態的電子則會自發的返回低能態,能量差作為光子被釋放至一個隨機的方向。前者就使那些原子有了類似於濾鏡的功能,觀測者在最後接收到的光譜中會發現一些黑色的吸收能帶。而後者能夠使那些與光線不在同一條直線上的觀察者觀察到一些不連續的譜線,實際就是那些原子的發射譜線。對這些譜線進行光譜學測量就能夠知道該物質的組成以及物理性質。
在對譜線進行了細緻的分析後,科學家發現一些譜線有著精細結構的裂分。這是因為自鏇與最外層電子運動間的相互作用,也被稱作自鏇-軌道耦合。當原子位於外部磁場中時,譜線能夠裂分成三個或多個部分,這個現象被叫做塞曼效應,其原因是原子的磁矩及其電子與外部磁場的相互作用。一些原子擁有許多相同能級電子排布,因而只產生一條譜線。當這些原子被安置在外部磁場中時,這幾種電子排布的能級就有了一些細小的區別,這樣就出現了裂分。外部電場的存在也能導致類似的現象發生,被稱為斯塔克效應。
如果一個電子在激發態,一個有著恰當能量的光子能夠使得該電子受激輻射,釋放出一個擁有相同能量的光子,其前提就是電子返回低能級所釋放出來的能量必須要與與之作用的光子的能量一致。此時,受激釋放的光子與原光子向同一個方向運動,也就是說這兩個光子的波是同步的。利用這個原理,人們設計出了雷射,用來產生一束擁有很窄頻率相干光源態物質很多不同的相態之中都存在原子,這些相態都由一定的物理條件所決定,例如溫度與壓強。通過改變這些條件,物質可以在固體、液體、氣體與電漿之間轉換。在同一種相態中,物質也可以有不同的形態,例如固態的碳就有石墨和金剛石兩種形態。當溫度很靠近絕對零度時,原子可以形成玻色-愛因斯坦凝聚態。
重要參數
質量數
(massnumber)由於質子與中子的質量相近且遠大於電子,所以用原子的質子和中子數量的總和定義相對原子質量,稱為質量數。
相對原子質量
原子的靜止質量通常用統一原子質量單位(u)來表示,也被稱作道爾頓(Da)。這個單位被定義為電中性的碳12質量的十二分之一,約為1.66×10-27kg。氫最輕的一個同位素氕是最輕的原子,重量約為1.007825u。一個原子的質量約是質量數與原子質量單位的乘積。最重的穩定原子是鉛-208,質量為207.9766521u。
摩爾
(mole)就算是最重的原子,化學家也很難直接對其進行操作,所以它們通常使用另外一個單位摩爾。摩爾的定義是對於任意一種元素,一摩爾總是含有同樣數量的原子,約為6.022×10^23個。因此,如果一個元素的原子質量為1u,一摩爾該原子的質量就為(1.66×10-27x6.022×10^23=9.99652x10-4≈10x10-4=0.001kg)0.001kg,也就是1克。例如,碳-12的原子質量是12u,一摩爾碳的質量則是0.012kg。
物質構成
金屬單質(鐵、銅等)
少數非金屬單質(例:金剛石、石墨)
現狀
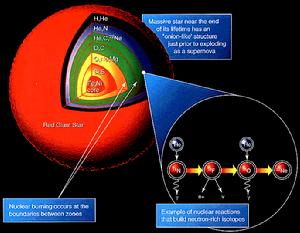 紅超巨星的剖面圖顯示出核合成和元素的形成
紅超巨星的剖面圖顯示出核合成和元素的形成核合成
穩定的質子和電子在大爆炸後的一秒鐘內出現。在接下來的三分鐘之內,太初核合成產生了宇宙中大部分的氦、鋰和氘,有可能也產生了一些鈹和硼。在理論上,最初的原子(有束縛的電子)是在大爆炸後大約380,000 年產生的,這個時代稱為重新結合,在這時宇宙已經冷卻到足以使電子與原子核結合了.自從那時候開始,原子核就開始在恆星中通過核聚變的過程結合,產生直到鐵的元素。
地球
大部分組成地球及其居民的原子,都是在太陽系剛形成的時候就已經存在了。還有一部分的原子是核衰變的結果,它們的相對比例可以用來通過放射性定年法決定地球的年齡。大部分地殼中的氦都是α衰變的產物.
地球上有很少的原子既不是在一開始就存在的,也不是放射性衰變的結果。碳-14是大氣中的宇宙射線所產生的。有些地球上的原子是核反應堆或核爆炸的產物,要么是特意製造的,要么是副產物。在所有超鈾元素──原子序數大於92的元素中,只有鈽和鎿在地球中自然出現
理論形式
雖然原子序數大於82(鉛)的元素已經知道是放射性的,但是對於原子序數大於103的元素,提出了“穩定島”的概念。在這些超重元素中,可能有一個原子核相對來說比其它原子核穩定。最有可能的穩定超重元素是Ubh,它有126 個質子和184 箇中子。
每一個粒子都有一個對應的反物質粒子,電荷相反。因此,正電子就是帶有正電荷的反電子,反質子就是與質子對等,但帶有負電荷的粒子。不知道什麼原因,在宇宙中反物質是非常稀少的,因此在自然界中沒有發現任何反原子。然而,1996年,在日內瓦的歐洲核子研究中心,首次合成了反氫──氫的反物質。
把原子中的質子、中子或電子用相等電荷的其它粒子代替,可以形成奇異原子。例如,可以把電子用質量更大的渺子代替,形成渺子原子。這些類型的原子可以用來測試物理學的基本預言。
磁性
電子是一種帶電體,正如所有帶電體一樣,電子鏇轉時會產生一個磁場,因此,不同的原子往往有不同的磁學特性。
分子軌道理論可以很好地解釋分子的磁性問題,例如氧氣的順磁性。
逆磁性
一些物質的原子中電子磁矩互相抵消,合磁矩為零。當受到外加磁場作用時,電子軌道運動會發生變化,而且在與外加磁場的相反方向產生很小的合磁矩。常見的逆磁性金屬有Bi、Cu、Ag、Au。
順磁性
順磁性物質的主要特點是原子或分子中含有沒有完全抵消的電子磁矩,因而具有原子或分子磁矩。但是原子磁矩之間並無強的相互作用(一般為交換作用),因此原子磁矩在熱騷動的影響下處於無規(混亂)排列狀態,原子磁矩互相抵消而無合磁矩。但是當受到外加磁場作用時,這些原來在熱騷動下混亂排列的原子磁矩便同時受到磁場作用使其趨向磁場排列和熱騷動作用使其趨向混亂排列,因此總的效果是在外加磁場方向有一定的磁矩分量。這樣便使磁化率(磁化強度與磁場強度之比)成為正值,但數值也是很小,一般順磁物質的磁化率約為十萬分之一(10-5),並且隨溫度的降低而增大。
常見的順磁性物質有:氧氣、一氧化氮、鉑。
核性質
放射性
某些物質的原子核能發生衰變,放出我們肉眼看不見也感覺不到的射線,只能用專門的儀器才能探測到的射線。物質的這種性質叫放射性。
衰變
不穩定(即具有放射性)的原子核在放射出粒子及能量後可變得較為穩定,這個過程稱為衰變(Radioactivedecay)。這些粒子或能量(後者以電磁波方式射出)統稱輻射(radiation)。由不穩定原子核發射出來的輻射可以是α(氦原子核)粒子、β(電子或正電子)粒子、γ射線或中子。
放射性核素在衰變過程中,該核素的原子核數目會逐漸減少。衰變至只剩下原來質量一半所需的時間稱為該核素的半衰期(half-life)。每种放射性核素都有其特定的半衰期,由幾微秒到幾百萬年不等。
原子核由於放出某種粒子而變為新核的現象.原子核是一個量子體系,核衰變是原子核自發產生的變化,它是一個量子躍遷過程,它服從量子統計規律.對任何一個放射性核素,它發生衰變的精確時刻是不能預知的,但作為一個整體,衰變的規律十分明確.若在dt時間間隔內發生核衰變的數目為dN,它必定正比於當時存在的原子核數目N,顯然也正比於時間間隔dt
衰變有3種:α衰變、β衰變和γ衰變。
核裂變(nuclearfission)
核裂變指是一個原子核分裂成幾個原子核的變化,核裂變通常由中子轟擊質量數較大的原子核引起,原子核裂變後會形成兩個質量相當的部分,並放出能量,有時會導致鏈式反應的發生。
核聚變(nuclearfusion)
當多個粒子聚集形成更重的原子核時,就會發生核聚變,例如兩個核之間的高能碰撞。常見的核聚變發生於氘與氚之間。核聚變是指由質量小的原子,主要是指氘或氚,在一定條件下(如超高溫和高壓),發生原子核互相聚合作用,生成新的質量更重的原子核,並伴隨著巨大的能量釋放的一種核反應形式。原子核中蘊藏巨大的能量,原子核的變化(從一種原子核變化為另外一種原子核)往往伴隨著能量的釋放。如果是由重的原子核變化為輕的原子核,叫核裂變,如核子彈爆炸;如果是由輕的原子核變化為重的原子核,叫核聚變,如太陽發光發熱的能量來源。
在太陽的核心,質子需要3-10KeV的能量才能夠克服它們之間的相互排斥,也就是庫倫障壁,進而融合起來形成一個新的核。
穩定性
原子核的穩定性,是指原子核不會自發地改變其質子數、中子數和它的基本性質。按原子核的穩定性可分為穩定原子核和不穩定(或放射性)原子核兩類。
1.原子核中的質子數等於和大於84的原子核是不穩定的。即原子序數84以後的元素均為放射性元素。
2.具有少於84個質子的原子核,質子數和中子數均為偶數時,其核穩定。
3.質子數或中子數等於2,8,20,28,50,82,126的原子核特別穩定。這些數稱為幻數。質子數和中子數都是幻數,稱為雙幻數核。
4.中子數和質子數之比n/p,在Z<20時n/p=1,原子核穩定。隨著原子序數增加,n/p值增大,比值越大,穩定性越差。
原子核衰變
不穩定的原子核都會自發地轉變成另一種核而同時放出射線,這種變化叫放射性衰變。原子核在衰變過程中放出的射線有三種:α射線、β射線和γ射線.
α射線是α粒子流,它是帶正電的氦核。β射線是高速運動的電子流。
β衰變有β+和β-兩種。β衰變時除放出正電子或負電子外,還放出中微子或反中微子。β-衰變是原子核內中子轉變成質子(留在核內)同時放出一個電子和與電子相聯繫的反中微子。β+衰變是原子核內中子數較少,質子轉變成中子(留在核內),同時放出一個正電子和一個中微子。
γ射線是光子流。通常是在α衰變或β衰變後形成新核時輻射出來的。這是因為放射性母核經上述衰變後,變成處於激發態的子核,子核在躍遷到正常態時,一般輻射出γ光子。
衰變前粒子的電荷總數和質量總數與衰變後所有粒子的電荷總數和質量總數相等
放射性衰變定律
t時樣品中有N個核,在dt時間內有dN個發生衰變,有t=0,N=N0,有上式稱為放射性衰變定律。
物理意義為:t時刻,每單位時間衰變的原子核數與該時刻原子核總數的比。越大,衰變越快。
習慣上常用半衰期來表征放射性元素衰變的快慢。半衰期的定義是:原子核衰變到N=N0/2所需的時間。用T表示。
有時也用平均壽命τ表示衰變的快慢。平均壽命是指每個原子核衰變前存在的時間的平均值。
放射性活度(也稱放射性強度)是指一個放射源,在單位時間內發生的核衰變次數。
在國際單位制中,放射性活度的單位是貝克勒爾(Bq)。1Bq表示每秒發生一次核衰變的放射源的活度。常用的單位還有居里(Ci)。
光譜
主條目:原子軌道
在穩定狀態下,原子中的電子位於離核最近的軌道上,這時的原子就被稱為基態原子;電子吸收能量後躍遷到更高的軌道上,這時原子就處於激發態。由於原子的軌道是量子化的,因此原子的能量發生變化時,會吸收(放出)特定的能量,產生不同的光譜圖像,古斯塔夫·羅伯特·基爾霍夫(GustavRobertKirchhoff)和羅伯特·威廉·本生(RobertWilhelmBunson)最早套用這一性質對不同元素的原子進行鑑定。
焰色反應(flametest)
當原子的光譜落在可見光區時,肉眼就可以看見不同的顏色,這是有些元素的原子在灼燒時引起火焰顏色變化的原因,這種變化被稱為焰色反應,可以粗略地檢測某些元素原子的存在。
價電子
價電子是原子參與化學反應的電子數,價電子數與原子的化學性質密切相關,對於主族元素來說,價電子數等於其最外層電子數;對於副族元素,價電子數包括最外層電子數和次外層的d(有時還包括f)軌道的電子數,元素周期表中通常會用電子排布式標示一個特定元素的價電子。根據價電子的不同,元素周期表可以分為s區、p區、d區、ds區、f區。
化合價
電離能
電離能的大小反映了原子失去電子的難易。電離能愈小,原子失去電子愈易,反之同理;電離能的大小和原子的有效電荷、原子半徑和電子排布有很大關係。
第一電離能
基態氣體原子失去電子成為帶一個正電荷的氣態正離子所需的能量稱為第一電離能,一般來說,若不作說明,電離能即第一電離能。
公式總結
1.α粒子散射試驗結果a)大多數的α粒子不發生偏轉;(b)少數α粒子發生了較大角度的偏轉;(c)極少數α粒子出現大角度的偏轉(甚至反彈回來)
2.原子核的大小:10-15~10-14m,原子的半徑約10-10m(原子的核式結構)
3.光子的發射與吸收:原子發生定態躍遷時,要輻射(或吸收)一定頻率的光子:hν=E初-E末{能級躍遷}
4.原子核的組成:質子和中子(統稱為核子),{A=質量數=質子數+中子數,Z=電荷數=質子數=核外電子數=原子序數〔見第三冊P63〕}
5.天然放射現象:α射線(α粒子是氦原子核)、β射線(高速運動的電子流)、γ射線(波長極短的電磁波)、α衰變與β衰變、半衰期(有半數以上的原子核發生了衰變所用的時間)。γ射線是伴隨α射線和β射線產生的〔見第三冊P64〕
6.愛因斯坦的質能方程:E=mc2{E:能量(J),m:質量(Kg),c:光在真空中的速度}
7.核能的計算E=mc2{當m的單位用kg時,E的單位為J;當m用原子質量單位u時,算出的E單位為uc2;1uc2=931.5MeV}〔見第三冊P72〕。
註:
(1)常見的核反應方程(重核裂變、輕核聚變等核反應方程)要求掌握;
(2)熟記常見粒子的質量數和電荷數;
(3)質量數和電荷數守恆,依據實驗事實,是正確書寫核反應方程的關鍵;
(4)其它相關內容:氫原子的能級結構〔見第三冊P49〕/氫原子的電子云〔見第三冊P53〕/放射性同位數及其套用、放射性污染和防護〔見第三冊P69〕/重核裂變、鏈式反應、鏈式反應的條件、核反應堆〔見第三冊P73〕/輕核聚變、可控熱核反應〔見第三冊P77〕/人類對物質結構的認識。
元素性質
| 為了方便閱讀者查閱元素周期表中各元素符號的性質及特點,比較系統的歸納和總結各元素的套用價值及注意事項,從而為需要相關知識的人們形成知識的鏈條,本次主要是對有些元素的內容進行補充及完善。 |