基本內容
影響原子半徑的因素有三個:一是核電荷數,核電荷數越多其核對核外電子的引力越大(使電子向核收縮)則原子半徑越小;當電子層數相同時,其原子半徑隨核電荷數的增加而減小;二是核外電子數,核外電子數越多半徑越大;三是電子層數(電子的分層排布與離核遠近空間大小以及電子云之間的相互排斥有關),電子層越多原子半徑越大。當電子層結構相同時,質子數越大,半徑越小。原子半徑大小由上述一對矛盾因素決定。核電荷數增加使原子半徑縮小,而電子數增加和電子層數增加使原子半徑增加。當這對矛盾因素相互作用達到平衡時,原子就具有了一定的半徑。
我們只要比較上述這對矛盾因素相互作用的相當大小就不難理解不同原子半徑大小的變化規律。
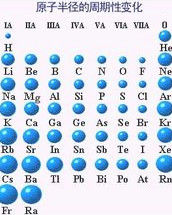
一.同周期原子半徑大小規律。
 原子半徑
原子半徑例如,比較鈉和鎂的半徑大小。
從鈉到鎂核電荷增加1個,其核對核外每一個電子都增加一定的作用力,原子趨向縮小,而核外電子也增加一個電子,因電子運動要占據一定空間而使原子半徑趨向增加。實驗證明,鈉的原子半徑大於鎂,這說明增加的核電荷對原子半徑的縮小作用>增加的電子對原子半徑的增大作用。因此,同周期元素的原子從左到右逐漸減小(稀有氣體除外)。
二.相鄰周期元素原子半徑大小比較。
實驗結果鉀原子半徑>鈉原子半徑,這說明從鈉到鉀,增加的八個電子和增加的一個電子層對原子半徑的增大作用>增加的八個核電荷對原子半徑的縮小作用。所以,同主族元素的原子半徑從上到下逐漸增加。氖到鈉核電荷增加1個,核外電子和電子層均增加一個 ,由此推斷,鈉的半徑>氖的半徑,即:增加的一個電子和一個電子層對原子半徑的增加作用>增加的一個核電荷對原子半徑的縮小作用。值得注意的是,並不是電子層多的原子半徑就一定大,如:鋰原子半徑>鋁原子半徑。這是因為當核電荷增加到大於八以後,其核對半徑的縮小作用越來越強已經超過了增加一個電子層對半徑的增加作用。
三.某原子及其陰離子或陽離子半徑大小比較。
例如,氯原子和氯離子半徑大小比較。
兩者核電荷相同而氯離子多一個電子,這一電子運動要占據一定的空間,所以氯離子半徑>氯原子半徑。
原子及其陽離子半徑正好與上述相反。例如:鈉離子半徑<鈉原子半徑。
四.電子層結構相同而核電荷不同的粒子半徑大小比較。
例如,鈉離子,鎂離子,氧離子,氟離子半徑大小比較。
因其核外電子層結構相同,顯然核電荷越多核對核外電子引力越大則粒子半徑越小。所以其粒子半徑大小是:鎂離子<鈉離子<氟離子<氧離子。
化學術語
1介紹:原子半徑通常是指以實驗方法測定的相鄰兩種原子核間距離的一半。從理論上說,核外電子無嚴格固定的運動軌道,所以原子的大小無嚴格的邊界,無法精確測定一個單獨原子的半徑,因此通常所使用的原子半徑數據只有相對的、近似的意義。根據測定的方法不同,有3種原子半徑(1)共價半徑:兩原子之間(原子可以相同也可以不相同)以共價鍵結合時,兩核間距離的一半。實際上核間距離即是共價鍵的鍵長。
(2)金屬半徑:金屬晶體中相鄰兩金屬原子間距離的一半。
 原子半徑
原子半徑(3)範式半徑:靠范德華力相互吸引的相鄰不同分子中的兩個相同原子核間距離的一半。
原子半徑大小與以下三個方原子半徑面有關
電子層數核內質子數電子數
(核內質子數=核電荷數)
1.電子層數越多原子半徑就越大
2.核內質子多那么原子核質量就大對電子的束縛能力就強原子半徑反而越小
3.電子數越多原子半徑越大
比較同一周期的原子半徑大小就看核內質元素原子半徑與原子序數關係子數
比較同一族元素就看電子層數
如果兩種元素的周期和族都不同那么主要考慮電子層數與最外層電子數一般沒有關係
如果將原子假設成一個球體的話,標準原子的直徑大約為10的-10次方米。
2補充特別說明:指原子相互作用有效範圍的一半,亦即相鄰原子核間距的一半。則原子半徑約為10^(-10)m。
