組成
我們早已知道,白色的無水硫酸銅溶於水時形成藍色溶液,這是因為生成了銅的水合離子。銅的水合離子組成為[Cu(H2O)4]2+,它就是一種絡離子。膽礬CuSO4·5H2O就是一種絡合物,其組成也可寫為[Cu(H2O)4]SO4·H2O,它是由四水合銅(Ⅱ)離子跟一水硫酸根離子結合而成。在硫酸銅溶液里加入過量的氨水,溶液由藍色轉變為深藍。這是因為四水合銅(Ⅱ)離子經過反應,最後生成一種更穩定的銅氨絡離子[Cu(NH3)4]2+而使溶液呈深藍色。如果將此銅氨溶液濃縮結晶,可得到深藍色晶體[Cu(NH3)4]SO4,它叫硫酸四氨合銅(Ⅱ)或硫酸銅氨,它也是一種絡合物。又如,鐵的重要絡合物有六氰合鐵絡合物:亞鐵氰化鉀K4[Fe(CN)6](俗名黃血鹽)和鐵氰化鉀K3[Fe(CN)6](俗名赤血鹽)。這些絡合物分別含的六氰合鐵(Ⅱ)酸根[Fe(CN)6]4-絡離子和六氰合鐵(Ⅲ)酸根[Fe(CN)6]3-絡離子,它們是由CN-離子分別跟Fe2+和Fe3+絡合而成的。Fe3+又與F-、SCN-發生絡合反應。
由以上例子可見:絡離子是由一種離子跟一種或多種分子,或由兩種或多種不同離子所形成的一類複雜離子或分子。
絡合物的組成以[Cu(NH3)4]SO4為例說明如下:
⑴絡合物的形成體,常見的是過渡元素的陽離子,如Fe3+、Fe2+、Cu2+、Ag+、Pt2+等。
⑵配位體可以是分子,如NH3、H2O等,也可以是陰離子,如CN-、SCN-、F-、Cl-等,甚至是陽離子,如NO+。
⑶配位數是直接同中心離子(或原子)絡合的配位體的數目,最常見的配位數是6和4。
絡離子是由中心離子同配位體以配位鍵結合而成的,是具有一定穩定性的複雜離子。在形成配位鍵時,中心離子提供空軌道,配位體提供孤對電子。
絡離子所帶電荷是中心離子的電荷數和配位體的電荷數的代數和。
絡合物的化學鍵:絡合物中的絡離子和外界離子之間是以離子鍵結合的;在內界的中心離子和配位體之間以配位鍵結合。組成絡合物的外界離子、中心離子和配位體離子電荷的代數和必定等於零,絡合物呈電中性。
絡離子一般比較穩定,但在水溶液中也存在著電離平衡,例如:
[Cu(NH3)4]2+=Cu2++4NH3
因此在[Cu(NH3)4]SO4溶液中,通入H2S時,將會生成CuS(極難溶);若加入強酸如H2SO4至pH1-2,同樣也會使溶液變回天藍色(即[Cu(H2O)4]2+的顏色)。
相關詞條
 絡合反應
絡合反應【配位化合物】見絡合物條。
【中心離子】在絡合單元中,金屬離子位於絡離子的幾何中心,稱中心離子(有的絡合單元中也可以是金屬原子)。如[Cu(NH3)4]2+絡離子中的Cu2+離子,[Fe(CN)6]4-絡離子中的Fe2+離子,Ni(CO)4中的Ni原子等。價鍵理論認為,中心離子(或原子)與配位體以配位鍵形成絡合單元時,中心離子(或原子)提供空軌道,是電子對的接受體。
【配位體】跟具有空的價電子軌道的中心離子或原子相結合的離子或分子。一般配位體是含有孤對電子的離子或分子,如Cl-、CN-、NH3、H2O等;如果一個配位體含有兩個或兩個以上的能提供孤對電子的原子,這種配位體稱作多齒配位體或多基配位體,如乙二胺:
H2N—CH2—CH2—NH2,三乙烯四胺:H2N—C2H4—NH—C2H4—NH—C2H4—NH2
等。此外,有些含有π鍵的烯烴、炔烴和芳香烴分子,也可作為配位體,稱π鍵配位體,它們是以π鍵電子與金屬離子絡合的。
【絡離子】見絡合物條。
【內界】在絡合物中,中心離子和配位體組成絡合物的內界,通常寫在化學式的[]內加以標示,如:[Cu(NH3)4]SO4
【外界】絡合物內界以外的組成部分稱外界。如[Cu(NH3)4]SO4中的SO24-離子。外界離子可以是陽離子,也可以是陰離子,但所帶電荷跟內界絡離子相反。在絡合物中外界離子與內界絡離子電荷的代數和為零。
【配位數】在絡合單元中,一個中心離子(或原子)所能結合的配位體的配位原子的總數,就是中心離子(或原子)的配位數。如[Fe(CN)6]4-中,Fe2+是中心離子,其配位數為4,二氨基乙酸合銅(見絡合物)中Cu2+是中心離子,它雖然與兩個二氨基乙酸離子絡合,但是直接同它絡合的共有4個原子(2個N原子,2個O原子),因此Cu2+的配位數也是4。
【配位原子】配位體中具有孤對電子並與中心離子(或原子)直接相連的原子。
【單齒配位體】又稱單基配位體,是僅以一個配鍵(即孤電子對)與中心離子或原子結合的配位體。如[Ag(NH3)2]+中的NH3分子,〔HgI4]2-中的I-離子,[Cu(H2O)4]2+中的H2O分子等。
【單基配位體】見單齒配位體條。
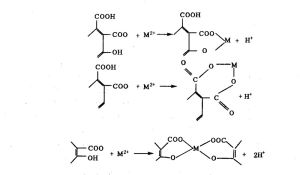
【多齒配位體】又稱多基配位體,若一個配位體含有兩個或兩個以上的能提供孤電子對的原子,這種配位體就叫多齒配位體。如乙二胺H2N—CH2—CH2—NH2,乙二胺四乙酸酸根離子(EDTA):
【多基配位體】見多齒配位體條。
【螯合物】見絡合物條。
【螯環】螯合物中所形成的環狀結構。一般以五元環和六元環為穩定。
【螯合劑】能夠提供多齒配位體和中心離子形成螯合物的物質。
【螯合效應】對同一種原子,若形成螯合物比單基配位體形成的絡合物(非螯合物)要更加穩定,這種效應稱作螯合效應。螯合物一般以五元環、六元環為最穩定,且一個絡合劑與中心離子所形成的螯環的數目越多就越穩定。以銅離子Cu2+和氨分子及胺類形成的絡合物為例:
[Cu(NH3)4]2+lgK=12.59
[Cu(en)2]2+lgK=19.65
[Cu(H2NCH2CH2NHCH2)2]2+lgK=21.41
[Cu(NHCH2CH2)4]2+lgK=24.64
【內軌型絡合物】價鍵理論認為中心離子(或原子)和配位體以配位鍵結合,中心離子(或原子)則以雜化軌道參與形成配位鍵。若中心離子(或原子)以(n—1)d、ns、np軌道組成雜化軌道與配位體的孤對電子成鍵而形成的絡合物叫內軌型絡合物。如〔Fe(CN)6]4-離子中Fe2+以d2sp3雜化軌道與CN-成鍵;[Ni(CN)4]2-離子中Ni2+以dsp2雜化軌道與CN-成鍵。內軌型絡合物的特點是:中心離子(或原子)的電子層結構發生了變化,沒有或很少有未成對電子,因軌道能量較低,所以一般比外軌型絡離子的穩定性較強。
【外軌型絡合物】若中心離子(或原子)以ns、np、nd軌道組成雜化軌道與配位體的孤對電子成鍵而形成的絡合物叫外軌型絡合物。一般第四周期過渡金屬離子在水中的形態均為外軌型配合物,如[Cr(H2O)6]3+為sp3d2雜化的水配合物。外軌型絡合物的特點是:中心離子(或原子)的電子層結構未發生變化,一般有一個至多個未成對電子,離子性較內軌型配合物強,一般不如內軌型配合物穩定。但如Fe3+,Al3+的F-配合物,由於陽離子電荷較高而比較穩定。
絡合滴定
以絡合反應(形成配合物)反應為基礎的滴定分析方法。絡合反應廣泛地套用於分析化學的各種分離與測定中,如許多顯色劑,萃取劑,沉澱劑,掩蔽劑等都是絡合劑,因此,有關絡合反應的理論和實踐知識,是分析化學的重要內容之一
配位反應是金屬離子(M)和中性分子或陰離子(稱為配位體,以L表示)配位,形成配合物的反應,配位反應具有極大普遍性。
一.簡單絡合物
許多無機配位劑只含有一個可鍵合的原子,稱為單齒(基)配位體,與M逐級地形成簡單配位絡合物。多數不穩定,相鄰兩級lgβ相差很小,溶液中常有多種逐級配合物同時存在,所以除個別反應(氰量法,汞量法)外,大多數反應不能用於滴定分析,主要用作掩蔽劑,顯色劑及指示劑。
二.螯合劑
有機配位劑分子中常含有兩個以上可鍵合的原子,稱為多齒配位體,與M配位時形成低配位比、環狀結構的螯合物,減少甚至消除了分級絡合(配位)的現象,配合物穩定性增高,廣泛用作滴定劑和掩蔽劑等。
⒈乙二胺四乙酸
廣泛用作絡合滴定劑的,是氨羧配位劑,分子中含有氨氮和羧氧配位原子,它們的配位能力很強,幾乎能與所有金屬離子配合,其中套用最廣的是乙二胺四乙酸(EDTA)
①在水中溶解度較小(22℃為0.02g/100ml)難溶於酸和有機溶劑,易溶於NaOH或NH3,通常使用其二鈉鹽Na2H2Y(22℃溶解度為為11.1g/100ml,約為0.3mol/L,PH≈4.4).也簡稱為EDTA.C=0.01mol/L溶液PH≈4.8(可按兩性物質計算)
②EDTA本身為四元酸其實相當於六元酸,有六級離解平衡,在任何水溶液中總以EDTAH62+——EDTA4-七種型態存在。③絡合性能廣(幾乎能與所有金屬離子配位);絡合物相當穩定(生成有多個五元環的螯合物,環個數越多越穩定,環大小也有影響,其中五六元環最穩定).三價,四價及大多數二價金屬離子lg>15;鹼土金屬形成配合物的傾向較小,但與EDTA的lg也在8~11,也可用EDTA滴定;一價金屬離子的不穩定.
④配位比一般為1:1
除極少數高價離子外,如MoO2+:Y=2:1
⑤絡合物水溶性好,絡合反應速度大多較快,為絡合滴定提供了有利條件.
⑥M(無色)+EDTA(無色)絡合物,有利於用指示劑確定終點.
M(有色)+EDTA(顏色更深)的絡合物,故要控制[M].如絡合物顏色太深,只能用電位法檢測終點(如EDTA還可作為Co的顯色劑進行比色測定)
⑦1:n的配合物大多不很穩定,一般可忽略.
⑧缺點:選擇性差(組分之間相互干擾)
a.絡合物的穩定常數
金屬離子與EDTA大多形成1:1絡合物;M+Y=MY(為簡化省去電荷),反應的平衡常數表達式為:
稱為M-Y的穩定常數(形成常數),
絡合平衡
用它來衡量絡合物的穩定性,值越大,絡合物越穩定.對於單齒型絡合物,它是逐級形成的,並可逐級離解
不穩定常數又稱為離解常數.
絡合物多用穩定常數β表示,酸鹼則多用離解常數Ka,Kb(即K不穩)表示.
將逐級穩定常數漸次相乘,就得到各級累積穩定常數,簡稱累積常數,以β累計表示.
b.溶液中各級絡合物的分布
由(4-2)可得:
即可用游離[M],[L]和β表示,這在絡合平衡處理中很重要.
若溶液中金屬離子M的分析濃度為[M],則由MBE:
得各組分均僅僅是[L]的函式(比較酸鹼平衡分布分數中[c]僅是[H+]的函式)
以lg[L](P[L])為橫坐標,為縱坐標作圖,則得到分布圖。
三副反應係數
絡合滴定中所涉及的化學平衡比較複雜,除了被測金屬離子M和EDTA之間的主反應外,還存在不少副反應.
反應物(M,Y)發生副反應不利於主反應的進行,而生成物(MY)發生副反應則有利於主反應的進行.為了定量地表示副反應進行地程度,引入副反應係數.
⒈絡合劑Y的副反應係數
表示:未與M絡合的Y(EDTA)(未參加主反應的Y)各型體的總濃度是游離的多少倍
越大,因為,
越小,副反應越嚴重.=1時,
,表示絡合劑Y未發生副反
應,即未與M絡合的Y全部以游離Y形式存在.
)-酸效應係數
將酸看做氫絡合物,其穩定常數
用質子化常數表示
所以其累積質子化常數為:
★僅是的函式.酸度越高,
越大,Y參加主反應的能力越低.
例:P98例3,例4
★算式中雖有許多項,但在一定條件下,只有少數項(一般2~3項)是主要的,其餘項均可略去.
★通常較大,所以常採用其對數值lg(一般保留小數點後一位),
並將不同PH下的lg值列成表(P330~331)或繪成圖(P98圖3-5)
★酸度對值影響極大,僅當
PH11時,≈1,即此時Y才不與
發生副反應.
)-共存離子效應係數
溶液中有其他金屬離子N存在,也能與Y反應,則:
一般
)總
如還有第三種金屬離子P存在,則
例P99例5
⒉金屬離子M的副反應係數
表示未與Y絡合的M的各種型
體總濃度是游離的多少倍.
若M與絡合劑L(可能是緩衝劑,防止金屬離子水解所加的輔助絡合劑,掩蔽劑)或發生副反應
僅為的函式
若M與發生了副反應,則用代(4-9)式中的即可.
若M與A,B和同時發生副反應,則
例:P100例7,例8,例9
★必須注意的是(4-9)式中的
是指游離A的平衡濃度,而絡合劑A
大多是鹼,易與絡合.所以,在考慮M與A的副反應時,首先應考慮A與的副反應.
例:計算pH=9,時
的值
解:
⒊絡合物MY的副反應係數
這種副反應對主反應有利.
酸度較高時,能夠生成MHY,
鹼度較高時,能夠生成M(OH)Y,
MHY,M(OH)Y大多數不穩定,一般計算時忽略不計.
四.條件穩定常數(表觀穩定常數,穩
定常數)
當有副反應發生時,的大小不能反映主反應進行的程度,而應引入
來衡量絡合物的穩定性,表示反應進行的程度.
可見,M,Y發生副反應,使,MY發生副反應則使
一般忽略,則:
例:P103例10
絡合滴定原理
一.滴定曲線在酸鹼滴定中,隨著滴定劑的加入,溶液的發生變化,在化學計量點附近,溶液的PH發生突變,形成滴定突躍.與此相似,在絡合滴定中,隨著滴定劑(EDTA)的加入,,到計量點附近,溶液的發生突變,
也形成滴定突躍,利用適當的方法,可以指示終點.
絡合滴定反應:
⒈滴定前:M
⒉滴定開始至計量點前,加入EDTAV(ml),溶液組成:
MY+
由
可求出
一般忽略⑵式中的
⑴-⑵得
⒊計量點時,溶液組成:,
(MY離解出的)
注意:不是
★無副反應時:
有副反應時,則
上述是選擇指示劑的依據,也用
於求TE,所以很重要.
計量點後溶液組成:
設加入EDTAV(ml)
例:PH=10.00時,以0.02000mol/LEDTA滴定V=20.00mlC=0.02000mol/L,計算滴定突躍及計量點時
解:
SP-0.1%時:
SP時:
SP+0.1%時:
★影響突躍大小的因素:
⑴越大,突躍越大,見P108
圖3-6.而
另外,隨著滴定反應(例如
)的進行,溶液增
加,所以漸小,因此一般在絡合滴定中
使用緩衝溶液,使體系的PH基本不變.
例如緩衝液,
緩衝液
但緩衝劑有時與M有絡合反應(如P108)
⑵越大,滴定曲線起點越低
,突躍越大.見P108圖3-7
三金屬指示劑
在絡合滴定中,通常利用一種能與金屬離子生成有色絡合物的顯色劑來指示溶液中的變化以確定終點,這種顯色劑稱為金屬(離子)指示劑.
⒈金屬指示劑作用原理
金屬指示劑是一種①具有酸鹼指示劑性質的有機染料,能與被滴定M反應,形成一種與指示劑本身顏色不同的絡合物,
所以②又是一種絡合劑.
滴定開始:
M+In(顏色甲)MIn(顏色乙)
滴定開始時,加入指示劑溶液呈乙色.隨著EDTA的加入,M逐漸被絡合,生成MY.
到達計量點時,稍過量的EDTA進一步奪取MIn中的M,使In游離出來,引起溶液的顏色變化,使溶液呈甲色.
終點:
MIn(乙色)+YMY+In(甲色)
作為金屬指示劑應具備以下條件:
⑴MIn與In顏色應顯著不同,這樣終點顏色變化才明顯.In多為有機弱酸,其顏色隨PH而變,所以必須控制合適的PH範圍.例如:
鉻黑T(EBT)
(紫紅)(蘭)
(橙);MIn(紅)
所以應控制PH在6.3~11.6之間
二甲酚橙(XO),PH6.3呈紅色,Min為紫紅,所以適於PH<6的酸性溶液中.
MIn穩定性要適當,且,否則EDTA不能奪取MIn中的M,即使過了計量點也不變色,失去指示劑的作用,或使終點拖後.但MIn穩定性太低,就會提前出現終點,且變色不敏銳.
一般
⑶MIn易溶於水
⑷M與In反應必須迅速,可逆性好
⒉金屬指示劑的變色點()
(忽略M的副反應)
到達指示劑的變色點時,,則
★所以金屬離子指示劑不像酸鹼指示劑那樣都有一個確定的變色點.在選擇金屬指示劑時,應考慮控制體系的酸度,使儘量與一致,至少應在
突躍範圍內.
★如M也有副反應,則應使盡
量一致.,
例:鉻黑T與的絡合物的
,鉻黑T的累計質子化常數為
試計算pH=10時鉻黑T的值.
解:
★M與In有時還會形成1:2,1:3以及酸式絡合物,則計算很複雜,所以不少指示劑的由實驗測得.P333附表14列出了鉻黑T和二甲酚橙的
⒊金屬指示劑的封閉與僵化
封閉現象:某些NIn比MY更穩定,則溶
液一直呈現NIn的顏色(N可能是溶液中
存在的干擾離子),即使過了計量點也
不變色.消除NIn影響的辦法:加入掩
蔽劑,使干擾離子生成更穩定的絡合
物,不再與指示劑作用.
例如:PH=10時,以EBT為指示劑滴定
總量時,
等全封閉EBT,
(=21.38,=20.0)
無法確定終點.消除辦法:微量
可用三乙醇胺掩蔽,可用KCN掩蔽(或用).如干擾離子量太大,可需預先分離除去.
由於MIn+Y→MY+In可逆性差引起的封閉現象,可用返滴定.
⑵僵化現象:有些In或MIn在水中
溶解度小,使Y與MIn交換緩慢,終點
拖長.消除辦法:加入有機溶劑或
△以增大其溶解度.例如用PAN做指
示劑時,常加入酒精或在△條件下的
滴定.
三.終點誤差
用EDTA(Y)滴定M
TE=
設
餘下推導見書P110
又
又
(∵,
由於只有稀釋效應,絡合劑濃度基本不
變,所以)
∴(4-15)
即為林邦(Ringbom)誤差公式
★由TE計算式可知,越大(突躍
越大),越小(終點離計量點越
近),TE越小.
套用:
(1⑴_計算TE
例:P110例12,例13
⑵推導準確滴定的判別式
由TE式:
要使終點誤差≤TE,
用指示劑目測終點,單
位的不確定性
TE≤0.1%,,
TE≤0.3%,,
★實際上,單位很難達到,所
以絡合滴定TE一般在0.x%~1.0%之間,
若採用多元混配絡合物作指示劑或用儀
分法檢測終點,減少的不確定性,
可使TE減小.
例:PH=9.0氨性緩衝液中,用
mol/LEDTA滴定同濃度,問
=1.0mol/L時,⑴能否準確被
滴定⑵用EBT為指示劑,求TE=
解:⑴
所以
∵
∴可以準確滴定
⑵
可查附表14(P333)
四.單一離子滴定酸度控制
⑴最高酸度()
由林邦誤差公式可知,在一定的條件下,TE取決於.若
(M無副反應),則僅取決於-即酸度,由此可求得滴定的最高酸度
().
(若酸度再大,則增大,太小,TE便會超過允許範圍)
若,,,則由終點誤差計算式可得,
若,則
然後由附表10(P330)可查得相應得
★顯然,不同金屬,則不同,
∴為使達到8的也不同,
以作圖得酸效應曲線(林邦曲線),見P98圖3-5.(此相應於一定條件,即,
,,M無副反應)
★所以對於很穩定的絡合物,
如,-EDTA,可在高酸度下
(PH1)滴定.
弱酸性(PH5~6)
不穩定的
弱鹼性(PH9.5~10)
⒉最低酸度()
酸度過低,則增大,減小,甚至形成沉澱,影響絡合反應的進行可通過求
的溶度積來求得.
稱為絡合滴定的"適宜酸度範圍".
並非能準確滴定的最低酸度.
例如:EDTA滴定,,但即使PH=10時,仍很小.若加入適當的輔助絡合劑
,那么在PH=10時,
仍能保持足夠大,而保證準確滴定.但應控制其用量,否則由於輔助絡合劑與M的副反應導致降低以至無法準確滴定.
例:P115例16,例17
選擇性滴定
前面討論的都是滴定一種金屬離子的情況,而EDTA能與很多金屬離子生成穩定的絡合物,當多種金屬離子共存時往往互相干擾.因此,如何在混合離子中進行選擇滴定,便是絡合滴定中一個十分重要的問題.一,控制酸度進行分步滴定
若溶液中含M,N兩種金屬離子,均與EDTA形成絡合物,且,用EDTA滴定時,首先被滴定的是M,現要討論兩個問題:⑴有N存在時,能否準確滴定M,即M被定量滴定後才滴定N,這是分步滴定的問題.
⑵M滴定後,N能否繼續準確滴定這實際上是單一離子的滴定,這個問題前面已解決.
我們這一節需要解決:⑴
相差多大才能分步滴定.⑵應當在什麼酸度下滴定.
⒈分步(選擇)滴定的可能性
假設M不發生副反應
而
(若能準確分步滴定M,則計量點時
很小,∴很小,
可見,與PH無關;而決定於PH,繪製的關係
圖,關係圖如下:
兩線相交於E點,對應的PH為,此時.
⑴___酸度較高時,,
,,即N對Y的副反應可忽略,相當於N不存在時單獨滴定M(
隨著PH增大而增大)
⑵酸度較低,,
,,即N干擾嚴重,酸效應忽略,不受酸度影響,達最大值且恆定.
上式兩邊同時乘以,並取對數
即越大,越大而越小,則越大,滴定M反應的完全度就高.
★究竟要多大才能分步滴定取
決於TE,,.
①若,
則,又若,則
,一般常以作為能控制酸度準確分步滴定的判據.
★如M,N有其它副反應,則應判
★若,則
②若
(混合離子選擇滴定允許誤差較大),由終點誤差公式可計算得
,即.若,則
例:P116例18
⒉分步滴定中酸度的控制
多數情況下,分步滴定在達最大時進行有利
最高酸度,即時的PH
最低酸度開始沉澱時的pH(與單獨滴定M時相同)
★少數金屬離子極易水解,如Bi3+(書P117),而其大,往往選在pH1.4,但當PH=1.4時,
易水解.一般選擇PH=1,儘管此時
未達到最大值,但也有9.6>8.所以可在PH=1時滴定,然後加入六次甲基四胺調PH=5~6,繼續滴定
例:P117例19
二.使用掩蔽劑進行選擇滴定
若相差不大,
,甚至,就不能用控制酸度的方法分步滴定M.這時可加入一種掩蔽劑(絡合劑,沉澱劑,氧化還原劑)使降低以至消除,因而稱為掩蔽法.按所用反應類型的不同,分為絡合,沉澱,氧化還原掩蔽法,其中以絡合掩蔽法用的最多.
⒈絡合掩蔽法
將A和N的反應看作是N和Y反應的副反應,
可見由於加入A,使原來的β降低了
★為了得到良好的掩蔽效果,所選擇的掩蔽劑應滿足
⑴絡合後使lgK‘相差5’以上。
⑵A不與M絡合。
⑶NA無色(或淺色),才不影響終點的觀察。
★書P122~124列出一些常用的絡合掩蔽劑
★選擇性解蔽法:
如還要測定被掩蔽的N,可在滴定M後,加入解蔽劑破壞NA,使N釋放出來→解蔽法.
例如:測pb2+,Zn2+,其K穩相近,無法控制酸度分步滴定
2,氧化還原掩蔽法
加入一種O-R劑,利用O-R反應改變干擾離子的價態以消除干擾.例如:P-126
有些金屬離子高價酸根離子,不再和EDTA絡合,如:
3,沉澱掩蔽法
加入能與干擾離子生成的沉澱劑,使[N]降低,並在不分離沉澱的情況下直接滴定;
例如:Ca2+,Mg2+的相近,不能用控制酸度的辦法分步滴定;Ca2+,Mg2+其它性質也相似,找不到合適的絡合掩蔽劑;在溶液中也無法變價,不可O-R掩蔽;但其氫氧化物Ksp相差較大,若在PH≥12,Mg形成Mg(OH2)沉澱而不干擾Ca2+的測定.
測水的硬度:
第一份在pH10的NH3-NH4Cl體系中以EBT指示滴定總量。
第二份在pH12(加20%NaOH)下用鈣羧酸指示劑滴定Ca2+。
德國硬度以CaO計算,法國以CaCO3計算.(10=10mg/LCaO)
常用沉澱掩蔽劑見P125
沉澱掩蔽法不是一種理想的掩蔽法,常存在下列缺點:見P125
三.選用其它絡合滴定劑(P.126~127)
⒈_EGTA
⒉_EDTP
⒊_Trien(三乙撐四胺)
Mn2+Pb2+Ni2+
⒋910.414.0
⒔8718.0418.62
用EDTA滴Ni2+時,Mn2+,Pb2+干擾大.若改用Trien,則Mn2+不干擾,Pb2+也易掩蔽.
還有其它配位劑,如:CYDTA(即環已二胺四乙酸),NTA(氨三乙酸),NEDTA(2—羥已基二胺三乙酸)等,但套用都不廣泛.
若採用上述控制酸度、掩蔽,或選用其它滴定劑均不能消除干擾離子的影響,只好分離,儘管麻煩,但有時不可避免.
方式及套用
絡合滴定可採用不同的滴定方式,這樣不僅擴大了絡合滴定的套用範圍(可直接或間接測定周期表中大多數元素),而且有時可以提高絡合滴定的選擇性.⒈直接滴定(P128)
如金屬離子與EDTA的反應能滿足滴定分析的要求,就可以直接滴定.條件如下:
①lgK'大(至少5)。
②絡合速度很快(例如Al3+,Cr3+,Zr4+與Y絡合物雖穩定,但常溫下反應很慢,不能直接滴定)
③有變色敏銳的指示劑,且無封閉現象;
④在滴定條件下,被測M不水解或生成其他穩定配合物(可加輔助絡合劑);
例如:Pb2+可以用酒石酸根絡合後在pH10下以EBT作指示劑滴定。
⒉返滴定(P128)
返滴定是在試液中先加入已知量過量的EDTA,使待測離子與EDTA絡合完全,然後用另一種金屬離子標液作為返滴定劑,滴定過量的EDTA.主要用於下列情況:
EDTA滴定Al3+正是如此:
①Al3+與EDTA絡合緩慢;
②Al3+對XO等指示劑有封閉作用;
③酸度不高時,Al3+水解生成一系列多核氫氧基絡合物,如:
即使在EDTA滴定Al3+的最高酸度(PH≈4.1),仍不能避免多核絡合物的形成,多核羥絡合物使Al3+與EDTA絡合更慢.∴不能用直接法滴定;
★pH=3.5<4.1,此時酸度較大,又有過量的EDTA存在,不會形成多核氫氧基絡合物.
★冷卻後調pH5~6是保證Al3+與EDTA定量絡合完全.
*返滴定劑N與EDTA(NY)應有足夠的穩定性,以保證測定的準確度.但若NY比MY(待測)更穩定,則N+MY=NY+M,使待測M的結果偏低,這是從平衡角度考慮.上例中ZnY比AlY稍穩定,但因AlY形成慢,離解也慢,∴在滴定條件下Zn不會把AlY中的Al3+置換出來.
⒊置換滴定
欲測多組分試液中的一種組分,採用置換法不僅選擇性高而且簡便,分為兩類:
①置換出金屬離子
M與EDTA反應不完全或形成的絡合物不穩定,可利用
M(待測)+NL=ML+N,
然後用EDTA滴N.
②置換出EDTA
將M與干擾離子N全部用EDTA絡合,然後加入選擇性高的絡合劑L奪取M,
MY+L=ML+Y,
釋放出與M等量的Y,然後用金屬標液滴定釋放出來的EDTA,即可得M的含量.
例如:複雜鉛樣中測Al3+:若其中還有Pb2+,Zn2+,Cd2+,Fe3+等,採用返滴定法測得的是Al3+與這些離子的總量;若要掩蔽這些干擾離子,必須先弄清有哪些組分,並加入多種掩蔽劑,不僅麻煩,且難以辦到.
Al3+(Fe3+,Zn2+等)
例如:測錫合金中的Sn(Ⅳ).
③間接滴定(P130)
有些金屬離子與EDTA絡合物不穩定,而非金屬離子不與EDTA絡合,此時可利用間接法測定.
例如:K+——六硝基合鈷(Ⅲ)酸鈉
Na+——醋酸鈾醯鋅鈉
Zn2+—
PO43-______
間接法手續繁雜,引入誤差機會較多,並不是理想的方法.
方程式舉例
Fe3++KSCN-=Fe(KSCN)3CaCl2+8NH3=CaCl2·8NH3
