簡介
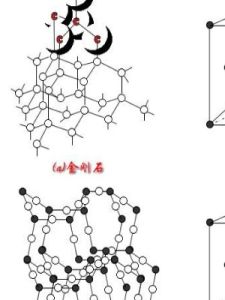
相鄰原子間以共價鍵結合而形成的空間網狀結構的晶體。例如金剛石晶體,是以一個碳原子為中心,通過共價鍵連線4個碳原子,形成正四面體的空間結構,每個碳環有6個碳原子組成,所有的C-C鍵鍵長為1.55×10-10米,鍵角為109°28′,鍵能也都相等,金剛石是典型的原子晶體,熔點高達3550℃,是硬度最大的單質。原子晶體中,組成晶體的微粒是原子,原子間的相互作用是共價鍵,共價鍵結合牢固,原子晶體的熔、沸點高,硬度大,不溶於一般的溶劑,多數原子晶體為絕緣體,有些如矽、鍺等是優良的半導體材料。原子晶體中不存在分子,用化學式表示物質的組成,單質的化學式直接用元素符號表示,兩種以上元素組成的原子晶體,按各原子數目的最簡比寫化學式。常見的原子晶體是周期系第ⅣA族元素的一些單質和某些化合物,例如金剛石、矽晶體、SiO2、SiC等。(但碳元素的另一單質石墨不是原子晶體,石墨晶體是層狀結構,以一個碳原子為中心,通過共價鍵連線3個碳原子,形成網狀六邊形,屬過渡型晶體。)對不同的原子晶體,組成晶體的原子半徑越小,共價鍵的鍵長越短,即共價鍵越牢固,晶體的熔,沸點越高,例如金剛石、碳化矽、矽晶體的熔沸點依次降低。理化性質
原子晶體,在這類晶體中,不存在獨立的小分子,而只能把整個晶體看成一個大分子。由於原子之間相互結合的共價鍵非常強,要打斷這些鍵而使晶體熔化必須消耗大量能量,所以原子晶體一般具有較高的熔點,沸點和硬度,在通常情況下不導電,也是熱的不良導體。熔化時也不導電,但半導體矽等可有條件的導電。由中性原子構成的晶體。原子間以共價鍵相聯繫。由於結合較牢,所以原子晶體的硬度較大,熔點較高。例如金剛石是由碳原子構成的原子晶體。石墨是由碳原子構成的另一種原子晶體,每一層碳原子之間結合較牢,但層與層之間為分子間力,結合較弱,因此容易沿層間滑移。矽、硼等單質以及碳化矽、氮化矽等許多化合物晶體都是原子晶體。原子晶體不導電、不易溶於任何溶劑,化學性質十分穩定。例如金剛石,由於碳原子半徑較小,共價鍵的強度很大,要破壞4個共價鍵或扭歪鍵角都需要很大能量,所以金剛石的硬度最大,熔點達3570℃,是所有單質中最高的。又如立方BN的硬度近於金剛石。
原子晶體中,組成晶體的微粒是原子,原子間的相互作用是共價鍵,共價鍵結合牢固,原子晶體的熔、沸點高,硬度大,不溶於一般的溶劑,多數原子晶體為絕緣體,有些如矽、鍺等是優良的半導體材料。原子晶體中不存在分子,用化學式表示物質的組成,單質的化學式直接用元素符號表示,兩種以上元素組成的原子晶體,按各原子數目的最簡比寫化學式。常見的原子晶體是周期系第ⅣA族元素的一些單質和某些化合物,例如金剛石、矽晶體、SiO2、SiC等。(但碳元素的另一單質石墨不是原子晶體,石墨晶體是層狀結構,以一個碳原子為中心,通過共價鍵連線3個碳原子,形成網狀六邊形,屬過渡型晶體。)
規律:原子晶體熔沸點的高低與共價鍵的強弱有關。一般來說,半徑越小形成共價鍵的鍵長越短,鍵能就越大,晶體的熔沸點也就越高。例如:金剛石(C-C)>二氧化矽(Si-O)>碳化矽(Si-C)晶體矽(Si-Si)。
1.原子間形成共價鍵,原子軌道發生重疊。原子軌道重疊程度越大,共價鍵的鍵能越大,兩原子核的平均間距—鍵長越短。
2.一般說來:結構相似的分子,其共價鍵的鍵長越短,共價鍵的鍵能越大,分子越穩定。
3.一般情況下,成鍵電子數越多,鍵長越短,形成的共價鍵越牢固,鍵能越大。在成鍵電子數相同,鍵長相近時,鍵的極性越大,鍵能越大,形成時釋放的能量就越多,反之破壞它消耗的能量也就越多,付出的代價也就越大。
晶體特點
比較金剛石和石英的晶體和晶胞
在這類晶體中,不存在獨立的小分子,而只能把整個晶體看成一個大分子。由於原子之間相互結合的共價鍵非常強,要打斷這些鍵而使晶體熔化必須消耗大量能量,所以原子晶體一般具有較高的熔點,沸點和硬度,在通常情況下不導電,也是熱的不良導體,熔化時也不導電,但半導體矽等可有條件的導電。原子間不再以緊密的堆積為特徵,它們之間是通過具有方向性和飽和性的共價鍵相聯接,特別是通過成鍵能力很強的雜化軌道重疊成鍵,使它的鍵能接近400KJ·mol。原子晶體中配位數比離子晶體少。
晶體結構
原子晶體二氧化矽晶體
結構特徵:空間立體網狀結構(如金剛石、晶體矽、二氧化矽等)。
原子晶體的結構特點:
①由原子直接構成晶體,所有原子間只靠共價鍵連線成一個整體 。
②由基本結構單元向空間伸展形成空間網狀結構。
③破壞共價鍵需要較高的能量。
在原子晶體的晶格結點上排列著中性原子,原子間以堅強的共價鍵相結合,如單質矽(Si)、金鋼石(C)、二氧化矽(SiO2)、碳化矽(SiC)金剛砂、金剛石(C)和氮化硼BN(立方)等。以典型原子晶體二氧化矽晶體(SiO2方石英)為例,每一個矽原子位於正四面體的中心,氧原子位於正四面體的頂點,每一個氧原子和兩矽原子相連。如果這種連線向整個空間延伸,就形成了三維網狀結構的巨型“分子”。
“比較金剛石和石英的晶體和晶胞”為金剛石面心立方晶胞。金剛砂(SiC)的結構與金剛石相似,只是C骨架結構中有將與C相連的4個C原子換為Si,再以Si為中心形成頂角為C的正四面體,形成C-Si交替的空間骨架。石英(SiO2)結構中Si和O以共價鍵相結合,每一個Si原子周圍有4個O原子排列成以Si為中心的正四面體,許許多多的Si-O四面體通過O原子相互聯接而形成巨大分子。
晶體類型
二維原子晶體時代的四方結構材料
某些金屬單質:晶體鍺(Ge)等。
某些非金屬化合物:氮化硼(BN)晶體。
單質:金剛石、晶體矽、晶體硼等。
化合物:碳化矽、二氧化矽等。
套用領域
原子晶體在工業上多被用作耐磨、耐熔或耐火材料。金剛石、金剛砂都是極重要的磨料;SiO2是套用極廣的耐火材料;石英和它的變體,如水晶、紫晶、燧石和瑪瑙等,是工業上的貴重材料;SiC、BN(立方)、Si3N4等是性能良好的高溫結構材料。