分子
測定
 分子結構
分子結構分子結構最好在接近絕對零度的溫度下測定,因為隨著溫度升高,分子轉動也增加。量子力學和半實驗的分子模擬計算可以得出分子形狀,固態分子的結構也可通過X射線晶體學測定。體積較大的分子通常以多個穩定的構象存在,勢能面中這些構象之間的能壘較高。
空間關係
分子結構涉及原子在空間中的位置,與鍵結的化學鍵種類有關,包括鍵長、鍵角以及相鄰三個鍵之間的二面角。
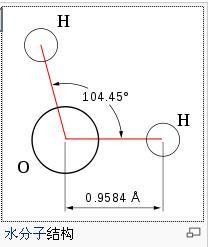
原子在分子中的成鍵情形與空間排列。分子結構對物質的物理與化學性質有決定性的關係。最簡單的分子是氫分子,1克氫含1023個以上的氫分子。水分子中2個氫原子都連線到一個中心氧原子上,所成鍵角是104.5°。分子中原子的空間關係不是固定的,除了分子本身在氣體和液體中的平動外,分子結構中的各部分也都處於連續的運動中。因此分子結構與溫度有關。分子所處的狀態(固態、液態、氣態、溶解在溶液中或吸附在表面上)不同,分子的精確尺寸也不同。
因尚無真正適用的分子結構理論,複雜分子的細緻結構不能預言,只能從實驗測得。量子力學認為,原子中的軌道電子具有波動性,用數學方法處理電子駐波(原子軌道)就能確定原子間或原子團間鍵的形成方式。原子中的電子軌道在空間重疊愈多,形成的鍵愈穩定。量子力學方法是建立在實驗數據和近似的數學運算(由高速電子計算機進行運算)相結合的基礎上的,對簡單的體系才是精確的,例如對水分子形狀的預言。另一種理論是把分子看成一個靜電平衡體系:電子和原子核的引力傾向於最大,電子間的斥力傾向於最小,各原子核和相鄰原子中電子的引力也是很重要的。為了使負電中心的斥力減至最小,體系儘可能對稱的排列,所以當體系有2個電子對時,它們呈線型排列(180°);有3個電子對時呈三角平面排列,鍵角120°。
極限類型
分子的鍵有三種極限類型,即離子鍵、共價鍵和金屬鍵。定位於2個原子之間的鍵稱為定域鍵
。由多個原子的共有電子形成的多中心鍵稱為離域鍵。此外還有過渡類型的鍵:鍵電子偏向一方的共價鍵稱為極性鍵,由一方提供成鍵電子的鍵稱為配位鍵。通過這些類型的鍵把原子按一定的空間排列結合成分子,形成分子的構型和構象。例如碳是共享電子對鍵(共價鍵)的基本參加者,碳和氫2 種元素的原子可形成烴類化合物,正四面體構的CH4是其中最簡單的烴,還可形成環狀化合物,例如環己烷;矽和氧是礦物質的基本元素,雲母和石英都含有矽氧單元 。金屬原子被夾在烴環平面中間構成夾心化合物。蛋白質的基本成分是一端接鹼性基,一端接酸性基的二官能分子α-胺基酸。化學組成和分子量相同但分子結構不同的物質互稱為異構體。當2 種異構體其他性質相同,只是鏇光方向相反,這一類異構體稱作鏇光異構體。可用X射線等衍射法、各種光譜、波譜、能譜和質譜法等測定或推測分子的結構。
溫度影響
由於分子中原子的運動由量子力學決定,因此“運動”這個概念也必須要建立在量子力學基礎之上。總體(外部)的量子力學運動——如平移和鏇轉幾乎不改變分子的結構(由鏇轉導致的科里奧利力和離心扭曲以及由此導致的形狀變化在此可以忽略)。內部運動包括振動,隸屬於諧波,即原子即使在絕對零度仍會在平衡間振盪。此時所有原子都處於振動基態,具有零點能量,振動模式的波函式也不是一個尖峰,而是有限寬度的指數。隨著溫度升高,振動模式(自由度)被熱激發,用通俗的話講是分子振動加快,而它們仍然只在分子特定部分振盪。
波爾茲曼分布可以量度溫度對分子振動的影響:exp(-ΔE/kT),其中ΔE是振動模式的激發能,k是波爾茲曼常數,T是絕對溫度。在298K(25 °C)下,典型的波爾茲曼因子值為:ΔE= 500 cm-1 --> 0.089;ΔE = 1000 cm-1 --> 0.008;ΔE = 1500 cm-1 --> 7 * 10-4。即,如果激發能為500 cm-1,那么大約9%的分子在室溫時會處於熱激發態。對水分子而言,其彎曲模式具有最低的激發能,大約為1600 cm-1,因此室溫下水分子中振動速度比絕對零度時快的分子占不到0.07%。
雖然轉動很難影響分子結構,但作為一個量子力學運動,相對振動而言它在低溫下熱激發程度較高。從經典力學角度來看即是,更多分子在高溫下轉動更快(它們具有更大的角速度和角動量);而從量子力學角度看則是,隨溫度升高,更多角動量較大的本徵態開始聚集。典型的轉動激發能數量級在幾cm-1。
由於涉及轉動態,很多光譜學的實驗數據都被擴大了。而轉動運動隨溫度升高而變得激烈,因此,低溫下的分子結構數據往往更加可靠,而從高溫下的光譜很難得出分子結構。
同分異構
具有相同化學式但不同結構的物質被稱為異構體,它們常有不同的性質。
純淨物只由異構體中的一種構成,因此所有分子結構相同。
構造異構體中原子排列順序不同,性質也常有不同,例如正丙醇和異丙醇。
官能團異構體是由於含有不同官能團而導致異構的異構體,例如醚和醇。
立體異構體物理性質可能類似(例如熔點和沸點),但生化活性一般不同。這是由於它們具有手性,必須要有特定的立體結構才可以與其他底物結合。一對立體異構體可使平面偏振光偏轉相同的角度,但是在相反方向上。
蛋白質摺疊關係到高分子蛋白質的構象取向問題。
結構類型
分子有六種基本形狀類型:
直線型:AB2型所有原子處在一條直線上,鍵角為180°,例如二氧化碳O=C=O。
平面三角形:所有原子處在一個平面上,三個周邊原子均勻分布在中心原子周圍,鍵角120°,例如三氟化硼BF3。
四面體:四個周邊原子處在四面體的四個頂點,中心原子位於四面體中心。理想鍵角109°28',例如甲烷CH4。
八面體:六個周邊原子處在八面體的六個頂點,中心原子位於四面體中心。理想鍵角90°,例如六氟化硫SF6。
三角錐形:四面體型的一條鍵被孤對電子占據,剩下三條鍵的形狀即是三角錐型。由於孤對電子體積較大,三角錐形的鍵角較四面體形的鍵角要小。例如氨NH3,鍵角107.312循環°。
四方錐形:八面體型的一條鍵被孤對電子占據,剩下五條鍵的形狀即是四方錐型,例如五氟化溴BrF5。
角形:與直線型相對,兩條鍵的三個原子不在一條直線上。例如水H2O,鍵角104.5°。
互斥理論
鍵連原子孤對電子電子對數 形狀 理想鍵角 例子 圖片
2 0 2 直線型 180° BeCl2
3 0 3 平面三角形 120° BF3
2 1 3 角形 120° SO2
4 0 4四面體109.5° CH4
3 1 4 三角錐 109.5° NH3
2 2 4 角形 109.5° H2O
5 0 5 三角雙錐 90°、120° PCl5
4 1 5 變形四面體90°、120° SF4
3 2 5 T型 90° ClF3
2 3 5 直線型 180° XeF2
6 0 6八面體90° SF6
5 1 6 四方錐 90° BrF5
4 2 6 平面正方形 90° XeF4