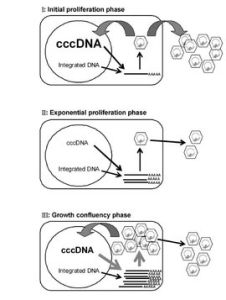
B肝病毒cccDNA的檢測方法
cccDNA和rcDNA在結構和理化特性上有三點不同:①rcDNA在正鏈與負鏈上均有缺口或缺刻,只是部分區域互補故能形成環狀結構,但非超螺旋結構;而cccDNA兩條鏈均是完整的,二者共價互補,形成超螺旋結構。②rcDNA能與蛋白質共價結合,cccDNA則不能。③由於缺口或缺刻的存在,rcDNA可以被一些核酸酶如外切核酸酶Ⅲ(exonuclease Ⅲ)、綠豆核酸酶(mung beannuclease)等降解成寡核苷酸或單核苷酸,而cccDNA則由於是超螺旋且雙鏈結構均是完整的,一般不會被上述酶降解。上述差異是設計和建立cccDNA檢測技術的基礎。本文就有關cccDNA 常用檢測方法作簡要介紹。
1.1 細胞內cccDNA的抽提與純化
最常用的抽提細胞內cccDNA的方法是蛋白質-去污劑沉澱法,其原理是基於rcDNA和cccDNA與蛋白質結合能力的差異。rcDNA能與蛋白質共價結合,與絕大多數細胞染色體DNA一起形成沉澱,而cccDNA不能與蛋白質結合故游離於上清中,用酚氯仿抽提上清即可得到cccDNA。根據筆者的經驗,該方法的主要缺點是:抽提較為費時,一般需要4~5小時;酚氯仿抽提環節多、得率不高;對於凍存的富集細胞(pellet)難以充分裂解,單裂解這一步可能需要3~4小時甚至更長時間。此外,在上清中實際仍然含有少量的rcDNA,而在沉澱中實際上也存在著一部分cccDNA。
為進一步分離cccDNA、rcDNA和單鏈DNA,可以對抽提產物進行純化。以酶 切法最為常用。外切核酸酶Ⅲ是一種3’→5’外切酶,對帶有鈍端、5’突出端或有缺口的雙鏈具有特異性,而不能降解帶有3’突出端(至少4個鹼基)的雙鏈DNA。綠豆核酸酶則以內切方式降解單鏈DNA或RNA,而保持雙鏈DNA的完整性(二者的比活性>1000),可用於選擇性切除雙鏈DNA的突出單鏈末端,以及切除單鏈DNA或RNA。也可單用綠豆核酸酶酶切rcDNA,或先用外切核酸酶Ⅲ將rcDNA降解成單鏈,然後再用綠豆核酸酶酶切。該方法也有其缺點:如抽提產物被稀釋,降低了檢測敏感度;綠豆核酸酶的反應緩衝液對PCR反應有抑制作用等。
我們嘗試用小量 質粒抽提試劑盒抽提去抽提HepG2.2.15細胞內的cccDNA,結果發現得率比上述所用方法均要高,操作也簡便,所有操作在30分鐘內就可完成。
1.2 cccDNA的定性檢測
既往絕大多數文獻報導的是用Southern blot對cccDNA進行定性檢測,該方法是分子生物學的經典方法,但技術要求較高,敏感度低。
近年來,也有較多文獻報導用PCR技術對cccDNA進行檢測。但是,由於PCR技術靈敏度極高,rcDNA和cccDNA的序列又具有高度的同源性,因此在用PCR技術檢測cccDNA時,必須確保只能擴增cccDNA而rcDNA不被擴增。目前利用rcDNA和cccDNA結構上的差異可以解決這一問題。由於rcDNA的正鏈和負鏈上均存在缺口,故可以設計跨越兩個缺口的引物,使rcDNA不會被擴增,而cccDNA由於是完整的雙鏈結構則可以被選擇性擴增。同時可設計另一對不跨越缺口的引物或只跨越一條鏈的缺口的引物同時檢測cccDNA和rcDNA。Kock等成功地用這種選擇性PCR的方法在檢測感染細胞內的cccDNA和rcDNA。
此外,為進一步提高檢測的靈敏度,可用套式PCR(nested PCR)的方法。
但是有報導認為跨缺口引物對兩種DNA的選擇性不是絕對的,在PCR檢測cccDNA時,起始模板量不能過高,否則rcDNA也有可能被擴增,Kock等發現每個PCR反應管中HBV DNA的量在1pg(約6×105拷貝)時能達到最佳的靈敏度與選擇性,因此在分析前應估計標本中HBVDNA的量。雖然套式PCR更為靈敏,但由於需取PCR產物進行再次擴增,因此在操作中要注意防止PCR產物污染,避免假陽性。
1.3 cccDNA的定量檢測
在定性檢測的基礎上,可以進一步對cccDNA進行定量檢測。仍以PCR定量分析技術中,尤其是競爭PCR技術的敏感性和精確度高。方法是在PCR反應管中加入一種已知量的、能與野生模板等效擴增的內參照,內參照是經過突變處理的,其兩端尤其是引物退火區的序列與野生模板相同。PCR擴增後通過一定的方法將野生片段與突變片段區分開,分別計算其絕對量,或求出其相對比值,就可以推算PCR擴增以前野生模板的量。
He等建立了實時螢光定量PCR檢測cccDNA的方法。他們將TaqmanMGB探針設計在負鏈缺刻的下游,與負鏈互補結合。對cccDNA,在上游引物的引導下,Taq酶到達TaqmanMGB探針所結合的位點,利用其5’→3’外切活性將探針切斷,3’端的淬滅基團失去對5’端的發光基團的抑制作用,從而產生螢光信號。每擴增一個cccDNA分子,就會產生一個螢光信號,PCR儀可對產生的信號進行實時監測,根據螢光信號的強弱對cccDNA進行定量。對rcDNA,由於上游引物引發的鏈延伸不能通過負鏈缺刻,故不能使TaqmanMGB探針被Taq酶切斷產生螢光信號。該方法的特異性比選擇性PCR進一步提高,可以消除高rcDNA背景可能產生的非特異性擴增。該方法的檢測低限可達100個拷貝,靈敏度比目前套用的任何一種其它方法都高。所有檢測在2小時內可完成。
還有其他一些更為敏感的檢測方法,如Shao等報告的兩步法對cccDNA進行實時螢光定量。其設計與He等的方法有異曲同工之處,即都是利用rcDNA與cccDNA分子結構上是否完整來有效地將二者區分開來,實現對cccDNA的特異性檢測。該方法在螢光探針位置的選擇上更符合螢光PCR的要求,即探針越靠近引物效果越好,這樣檢測到的螢光信號質量和實時擴增曲線形狀可能更佳,而在He等的方法中探針與上游引物點之間的距離則至少需要在230個鹼基以上。但是,該方法存在與套式PCR類似的缺點,即需要分兩步操作,單鏈延伸反應管開蓋後極有可能造成產物污染。
B肝病毒cccDNA檢測的臨床意義
2.1 評價抗B肝病毒藥物的新指標
目前臨床上評價干擾素、核苷類似物這些抗B肝病毒藥物時存在一個很大的問題,即其評價指標主要是肝功能的改善與否、血清B肝病毒DNA水平的變化以及肝組織的病理學改變等。誠然,這些指標對臨床醫生判斷患者病情而言非常重要和實用,也是臨床醫生選用抗B肝病毒藥物時的依據,然而對於何時停用抗病毒藥物、停用抗病毒藥物後B肝病毒是否會重新複製活躍導致B肝復發則缺乏客觀而有效的指標。開展肝細胞內B肝病毒cccDNA的動態的定量監測可以部分解決這個問題。治療前後肝細胞內B肝病毒cccDNA的含量的變化應該納入到抗B肝病毒藥物評價的指標體系中來,從一定意義上說,只有能夠徹底清除B肝病毒cccDNA的藥物,才能算是真正“有效”的抗病毒藥物。
Schultz等用鴨干擾素-γ(DuIFN-γ)分別在DHBV感染前後作用於原代培養鴨肝細胞,發現100U/ml的DuIFN-γ可使細胞內cccDNA水平下降至1/10~1/20。在DHBV感染前1天加DuIFN-γ,感染後4天細胞內仍然可以檢測到cccDNA,但僅相當於不加藥對照組感染後1天的水平,說明在DuIFN-γ作用下,新感染病毒的rcDNA仍然可以轉化為cccDNA,但子代rcDNA通過細胞內通路擴增形成cccDNA的過程受到抑制。Mason等以拉米夫定治療WHV感染的土撥鼠,結果發現可使血清病毒的滴度下降至初始水平的0.3%甚至更多,但在維持治療3~12個月後,95%的土撥鼠肝臟細胞中仍然能檢測到病毒,cccDNA水平無明顯改變,但有3隻土撥鼠感染肝細胞的比率和肝細胞內cccDNA的水平有顯著下降(給藥組2隻,對照組1隻),作者認為這可能是免疫清除的結果而非藥物的作用。Dandri等以不同劑量(1μmol/L、10μmol/L、100μmol/L)的阿德福韋(adefovir)作用於原代培養的WHV感染土撥鼠肝細胞,發現均可使WHVDNA合成下降90%,病毒顆粒的分泌量下降98%,但對cccDNA的合成沒有影響,對包膜蛋白的分泌和RNA的合成無作用。即使在培養基中加入表皮生長因子作用14天以誘導細胞轉化(turnover)發生分裂,但細胞內cccDNA水平仍無變化,提示cccDNA可被從母代細胞轉運到分裂形成的子代肝細胞中。L-Fd4C(2',3'-dideoxy-2',3'-didehydro-beta-L-5-fluorocytidine)是近年來發現和研究較多的核苷類抗病毒藥物,其體外抗病毒活性至少較拉米夫定強10倍。Zoulim等用Fd4C作用於原代培養的鴨肝細胞,發現它對逆轉錄酶的抑制作用強於拉米夫定等其它胞苷類似物,具有持久的抑制病毒複製的作用,但對cccDNA的水平沒有影響。當用Fd4C處理病毒感染的鴨和土撥鼠時,對病毒血症和DNA的合成也強於拉米夫定,但是停藥後很快復發,因為cccDNA在肝細胞內持續存在。上述結果均說明,儘管核甘類藥可以抑制HBVDNA複製,但不能清除cccDNA。
除干擾素和核苷類似物外,也有人研究了其他藥物對cccDNA的影響。Turin等用細胞周期阻斷劑丁酸鈉作用於體外培養的鴨肝細胞。丁酸鈉是一種細胞分裂抑制劑,能可逆地將細胞周期阻斷於G0/G1期。他們發現雖然它不能阻止起始的病毒基因組轉變為cccDNA,但可以抑制隨後的cccDNA擴增。但這種作用是可逆的,一旦撤除丁酸鈉,cccDNA水平又將上升。Thermet等用包含DHBV大包膜蛋白基因的質粒作為治療性DNA疫苗治療慢性攜帶DHBV的鴨,發現可以顯著減少病毒的複製,更有意義的是,在一些鴨(7/30)的肝細胞內,cccDNA已被完全清除。治療性DNA疫苗也許是一種清除HBV感染肝細胞內的cccDNA、減少復發的有前景的方法。其它旨在阻斷病毒在細胞內複製、轉錄、翻譯乃至釋放的某一個環節的抗病毒藥物則很難清除cccDNA,因為cccDNA池已經在感染肝細胞內形成,而肝細胞是相當穩定的幾乎不分裂的細胞,即使肝細胞發生分裂,cccDNA還可以被分配到子代細胞中去,並通過負反饋調節機制最終保持穩定。
2.2 評價抗B肝病毒是否能感染肝外組織的客觀指標之一
B肝病毒不僅僅是一種嗜肝病毒,一些肝外組織中也可檢測到B肝病毒DNA,如腎臟、胰腺以及外周血單個核細胞(peripheralblood mononuclearcell,PBMC)等。早就有人發現B肝病毒可以感染白細胞,而這種免疫細胞的感染似乎有利於病毒逃避免疫反應,從而導致機體清除B肝病毒的能力下降。關於PBMC能否被B肝病毒感染的問題目前仍有爭議,其中一個重要的原因是沒有確立PBMC被感染的標準。我們認為把PBMC細胞內是否存在cccDNA作為判斷感染的標準是最可靠的。cccDNA的形成是B肝病毒的侵入細胞後在細胞內進行複製的起始步驟,也是轉錄合成前基因組RNA(pregenomicRNA,pgRNA)的前體,是建立病毒感染狀態的最重要標誌,沒有cccDNA的形成也就沒有其後的一系列過程。Kock等用B肝病毒去感染體外培養的PBMCs時,發現不能在細胞內檢測到cccDNA,相反,如果轉染的是肝細胞,則非常容易檢測到cccDNA。此外,在B肝患者的肝組織內,能檢測到cccDNA和rcDNA,而在其PBMC中,則只能檢測到rcDNA。認為B肝病毒是不能感染PBMC,即使PBMC中檢測到B肝病毒,也只是血液的病毒DNA與PBMC表面牢固結合,不易被PBS等洗滌下來,抽提細胞所得到的病毒DNA其實並不存在於細胞內;或病毒僅僅是被PBMC所“吸收”(absorption),並沒有建立真正意義上的感染狀態。這一實驗結果給我們很多啟發,也加深了對B肝病毒感染的認識。
2.3 評價B肝患者病情
我們用選擇性螢光定量PCR對93例B肝患者血清作回顧性分析時,發現24例患者血清cccDNA呈陽性,其中急性B肝1例,慢性B肝(輕度)6例,慢性B肝(中度)6例,慢性B肝(重度)3例,肝炎肝硬化2例,慢性B肝(重型)6例,其中慢性B肝(中度)以上的病例占70%以上。雖然經過統計學分析還不能看出顯著差異,樣本量還不夠大,血清cccDNA陽性與病情的輕重是否存在某種關係還有待於進一步的深入研究。但是,從理論上推測,既然存在於肝細胞胞質和線粒體中的轉氨酶等酶類在肝細胞被破壞時能釋放到血液中,那么存在於肝細胞核內的cccDNA分子在肝細胞變性、壞死時應該也可以釋放到血液中,而且病情越嚴重,變性壞死的細胞越多,對於同一個患者而言,在某一時間段內,其血液中的cccDNA水平應該也相應地越高,對判斷病情有意義。目前通過肝活檢來監測B肝患者肝組織中的cccDNA水平變化存在著一定困難,因而監測血液中的cccDNA的動態變化也許更具有現實意義。當然,其中還存在一些問題有待研究和解決,比如血液中的cccDNA水平遠遠低於肝組織中的cccDNA水平,也遠遠低於血液中的的rcDNA水平,因此必須進一步提高cccDNA定量檢測的靈敏度。
 cccDNA
cccDNA