發展歷史
未成功的嘗試
1998年末,波蘭物理學家RobertSmolańczuk發表了一套計算法,以解釋如何通過融合原子核來合成超重元素的原子,當中也包括了Uuo。他的計算表示,在嚴格控制的環境下融合鉛和氪,就能製成Uuo。1999年,勞倫斯伯克利國家實驗室的研究人員利用這些計算,製造了Lv和Uuo,並將發現發布於《物理評論快報》。不久之後《科學》雜誌也報導了這一發現。研究人員聲稱成功進行了以下核反應:
2000年,因為其他的實驗室及勞倫斯伯克利國家實驗室本身都未能重複這些結果,所以研究人員撤回了該發現。2002年6月,實驗室主任宣布原先兩個元素的發現結果所用的數據是由VictorNinov編造的。
發現
2002年,位於俄羅斯杜布納由Yuri Oganessian帶領的團隊於聯合核研究所(JINR)首次發現並觀測到Uuo原子的衰變。2006年10月9日,來自聯合核研究所及美國加州勞倫斯利福摩爾國家實驗室的研究人員宣布他們間接探測到一共3個(可能4個)Uuo-294的原子(其中1或2個發現於2002年,其餘2個於2005年)。方法是通過撞擊鐦249和鈣48離子:Uuo-294同位素的放射性衰變示意圖。列出同位素的衰變能量和平均半衰期。進行自發裂變的原子以綠色表示。由於核聚變機率(聚變截面約為0.3–0.6pb= (3–6)×10 m)很低,實驗經過了48個月,使用了4×10個鈣離子,才第一次測得Uuo的合成。探測結果是隨機事件的可能性估計小於100,000分之1,所以研究人員很有把握這並不是誤測。實驗觀察到的有3個Uuo原子的α衰變,而研究人員也提出了第4個通過直接自發裂變的衰變。Uuo通過α衰變產生Lv。由於只觀測到3個原子的衰變,因此計算出來的半衰期有著很大的誤差:0.89−0.31ms。為了確定產生了Uuo,科學家再通過撞擊Cm和Ca離子,產生了Lv原子核:並比較Lv與Uuo原子核的衰變鏈是否相同。Lv原子核十分不穩定,半衰期只有14毫秒,便衰變為Fl,再經由自發裂變或α衰變成為Cn,然後進行自發裂變。根據量子穿隧模型,Uuo的α衰變半衰期預測為0.66−0.18ms,理論核反應能量(Q值)於2004年發表。如果在計算中使用Muntian–Hofman–Patyk–Sobiczewski巨觀微觀模型得出的Q值,則結果會相對較低,但仍很接近。在成功取得Uuo之後,科學家希望通過融合Fe和Pu來製造Ubn(Unbinilium,120號元素)。Ubn同位素的半衰期預計只有數微秒。| 目標 | 發射體 | CN | 結果 |
|---|---|---|---|
| Pb | Kr | Uuo | 至今失敗 |
| Cf | Ca | Uuo | 反應成功 |
命名
直至1960年代Uuo仍被稱為eka-emanation(emanation是氡的舊稱)。1979年IUPAC發表了對元素新命名的建議,並將其命名為ununoctium。該系統命名將在證實發現該元素且IUPAC授予名稱之前,作為118號元素的代替名。 Uuo
Uuo2002年發現結果被撤回之前,勞倫斯伯克利國家實驗室的研究人員曾建議以阿伯特·吉奧索(AlbertGhiorso,研究團隊的領導成員)命名為ghiorsium(Gh)。
俄羅斯的發現者於2006年公布發現Uuo。2007年,聯合核研究所主任表示,研究團隊正考慮兩個名字:以格奧爾基·弗廖羅夫(GeorgyFlyorov,杜布納的研究實驗室創立人)命名的flyorium,及以莫斯科州(MoscowOblast,杜布納所在地)命名的moskovium。他也表明,雖然這是俄美合作發現的(美國提供撞擊中的目標元素鐦),但Uuo名正言順地應以俄羅斯命名,因為聯合核研究所的Flerov核反應實驗室是世界上唯一一座能取得這種成果的設施。
性質
原子核穩定性
Uuo位於穩定島的右端,因此其原子核應比預測的更穩定一些。物理性質
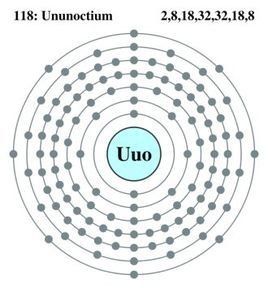
核反應製取方程式:Kr+Pb-->Uuo+n核外電子排布:2,8,18,32,32,18,8
推測Ununoctium的物理性質:
氣體,加壓可液化;
熔化點:≥-30℃;
沸點:≥-20℃;
顏色:無色(和其他六種稀有氣體(氦,氖,氬,氪,氙,氡)一樣)。
氣味:無
在X射線中可發出螢光(類同氡)
Uuo屬於18族,沒有價電子。這一族的元素的價電子層符合八隅體規則,因此幾乎對所有普通化學(如氧化作用)反應顯惰性。這樣形成的電子排布是ZZ緊密和穩定的,並擁有最低能量。科學家相信Uuo也同樣有填滿了的價電子層,其電子排布為:7s27p6。
一些人預計Uuo的物理及化學特性會與同族的其他元素相似,最接近其上的惰性氣體氡。根據周期表的趨勢,Uuo估計比氡更活躍一些。然而,理論計算卻顯示,它可能會非常活躍,並不一定能被稱為惰性氣體。Uuo甚至可能比Fl和鎶還活躍。Uuo的化學活性比氡明顯較高,要歸咎於其7p電子支殼層的徑向膨脹及能量的不穩定性。更準確地說,7p電子與7s電子間有著很大的自鏇-軌道作用,導致第二個價電子層在Fl處填滿,使Uuo的穩定性大大降低。
Uuo的極化性是之前所有元素中最高的,幾乎是氡的兩倍。從其他惰性氣體的沸點趨勢估計,Uuo的沸點處於320K和380K之間。這和先前的估值263K和247K要高。甚至在加上巨大的計算誤差後,Uuo在標準狀況下仍不會呈氣態。由於其他惰性氣體的液態溫度區間很小,介乎2K至9K間,所以Uuo應該是一種固體。如果它是氣體的話,將會是標準狀態下密度最高的氣體(儘管它和其餘的惰性氣體一樣是單原子的)。
由於極化性極高,Uuo的電離能異常低(類似於鉛,是氡的70%,明顯低於Fl),並擁有標準凝聚態。
同位素
原子序超過82(鉛)的元素均沒有穩定的同位素。原子核的穩定性隨原子序的增加而降低,因此所有原子序超過105( )的同位素半衰期都小於1天。然而由於一些尚待了解的原因(見魔數),原子序110至114的穩定性有著稍微的提升,這就是核物理所預測的“穩定島”。這個概念由伯克利加州大學教授格倫·西奧多·西博格提出,以解釋超重元素半衰期比本來預計要長的原因。Uuo是有放射性的,其半衰期少於1毫秒。不過,這數值已經比某些預計值較長,這進一步支持“穩定島”這一理論。量子穿隧模型計算預測,Uuo還有幾個α衰變半衰期接近1毫秒的多中子同位素。
理論計算顯示,一些Uuo同位素比已發現的Uuo更加穩定,最有可能的包括:Uuo、Uuo、Uuo、Uuo、Uuo、Uuo和Uuo。其中Uuo最有機會擁有長半衰期,所以可能會是未來的重點工作對象。一些Uuo附近的多中子原子核也可能有較長的半衰期。
預測化合物
科學家自1964年起便開始進行了有關Uuo的理論化合物的計算,但至今還沒有合成任何Uuo化合物。如果一個元素的電離能足夠高的話,它會非常難氧化,因此最可能的氧化態是0(正如其餘的惰性氣體)。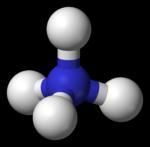 UuoF4預計擁有四面體結構
UuoF4預計擁有四面體結構對二聚體Uuo2的計算指出,化學鍵間的互動作用和Hg2的相約,鍵離解能為6kJ/mol,約為Rn2的四倍。但最出乎意料的是,其鍵長比Rn2的還短BBZ0.16Å。另外,化合物UuoH的鍵離解能(或Uuo的質子親和能)比RnH小。
UuoH中Uuo和氫之間的鍵可看作是純粹的范德華力,而不是真正的化學鍵。另外,Uuo與一些電負性高的元素能組成穩定的化合物,甚至超過鎶或Fl。氯化物UuoF2和UuoF4中,Uuo預測有穩定的+2和+4氧化態。這也是由於Uuo的自鏇-軌道作用。例如,計算顯示,Uuo和F2產生UuoF2的化學反應會釋出106kcal/mol的能量,其中約46kcal/mol來自於這些相互作用。對比之下,類似的分子RnF2的產生能量為49kcal/mol,互動作用占約10kcal/mol。同樣的相互作用使UuoF4的四面體形Td結構比較穩定,共價鍵,因此UuoFn化合物都不具有揮發性。Uuo的電正性足以與氯產生Uuo–Cl鍵,這於其他的惰性氣體非常不同。