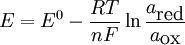影響因素
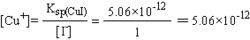 Nernst方程
Nernst方程影響電極電位的因素主要有二種,一種是電極的內在因素,即:電極的熱力學過程(物質的本性)是影響電極電位數值的決定因素;另外一種是外在因素,即溶液的濃度及溶液的pH值對電極電位的數值有影響。我們主要學習外在因素對電極電位的影響。
9.3.1 內因:電極的熱力學過程
9.3.2 外因
濃度對電極電勢的影響
pH對電極電勢的影響
1. Nernst方程(φ~c, φ~p, φ~pH的關係)
E=Eθ + RT/nF*ln[Ox/Red]
式中E──氧化型和還原型在絕對溫度T及某一濃度時的電極電勢(V)
Eθ──標準電極電勢(V)
R──氣體常數8.3143 J/(K·mol)
T──絕對溫度K
F──法拉第常數=NA(阿伏伽德羅常數=6.02×10^23個)×e(每個電子的電量=1.602189×10^-19庫倫)≈ 96500庫倫
n──電極反應中得失的電子數
[氧化型]/[還原型]:表示在電極反應中,氧化態一邊各物質濃度冪次方的乘積與還原態一邊各物質濃度冪次方的乘積之比,方次是電極反應方程式中相應各物質的係數;離子濃度單位為mol·L^(-1)(嚴格講應為活度);氣體用分壓表示,純固體、純液體濃度作為1。
這就是電動勢的 Nernst 方程,它反映了非標準電極電勢和標準電極電勢的關係。此式表明任意狀態電動勢與標準電動勢以及濃度、溫度之間的關係。
注意事項
套用Nernst方程的注意事項:
(1) φ的大小決定於[氧化型]/[還原型]活度的比
(2) 電對中的固體、純液體濃度為1,溶液濃度為相對活度,氣體為相對分壓。 p / pθ
(3) 氧化型、還原型的物質係數,作為活度的方次寫在Nernst方程的指數項中
(4) 有H+, OH– 參與時,當H+, OH– 出現在 氧化型時,H+, OH– 寫在方程分子項中, H+, OH– 出現在還原方時,H+, OH –寫在方程中分母項中。
(5) Nernst方程與溫度有關。
例如:MnO4- + 8H+ + 5e = Mn2+ + 4H2O
套用
2. Nernst方程的套用
①計算不同濃度下的電對電極電位數值;
②計算不同pH條件下的電極電位數值;
例1. [Cr2O72-] = [ Cr3+] =1.00 mol/dm3, 求[H+] = 10.0 mol/dm3及[H+] = 1.00´10-3 mol/dm3時電對Cr2O72- / Cr3+ 的電極電位:
解: Cr2O72- + 14 H+ + 6 e = 2 Cr3+ + 7 H2O
(1) 當 (H+) = 10.0 mol/dm3 時, 代入Nernst方程:
(2) 當 [H+] = 1.00´10-3 mol/dm3 時,代入Nernst方程:
由此可見H+濃度增大,電極電位減小。
例2:沉澱生成對電極電位的影響(氧化-還原平衡與沉-溶平衡共存)
計算φ θ (Cu2+/CuI),判斷標態下, 下列反應可否自發進行,並求Kθ。
2 Cu2++ 4 I- = 2 CuI(s) + I2 (s)
已知:
φθ(Cu2+/Cu+)=0.158V φθ(I2/I-)=0.535V
Ksp(CuI)=5.06×10-12
解:φθ(Cu2+/CuI)對應於下列反應:
Cu2++I-+e=CuI(s)
其中:CuI(s)=Cu++I-,[Cu+]受Ksp(CuI)制約,
例3:配合物生成對電極電位的影響。(氧化-還原平衡與配位平衡共存)
Co2+和Co3+分別與NH3(aq)反應生成Co(NH3)62+ 和Co(NH3)63+ , 求φθCo(NH3)63+/Co(NH3)62+。並判斷Co(NH3)62+ 在空氣中是否穩定。
已知: φθ (Co3+/Co2+) = 1.82 V, φθ (O2/OH-)= 0.401 V ,
b6 [Co(NH3)63+]=1.60×1035 , b6 [Co(NH3)62+]= 1.28×105
解:Co3+ + 6 NH3 = Co(NH3)63+
b6 [Co(NH3)63+]=1.60×1035
Co2+ + 6 NH3 = Co(NH3)62+
b6 [Co(NH3)62+]=1.28×105
可見,氨配合物的生成使(Co3+) 降低 , 遠超過使(Co2+) 降低的程度,[Co3+] 和[Co2+]由配位平衡決定。
φθ [Co(NH3)63+/ Co(NH3)62+]對應的電極反應為:
Co(NH3)63+ + e = Co(NH3)62+
[Co3+] 和[Co2+]不在標態, 由配位平衡決定。
而鹼性介質中,φθO2/OH- = 0.401V > φθCo(NH3)63+/Co(NH3)62+
4Co(NH3)62++O2+2H2O=4Co(NH3)63++4OH-
φθ = φθO2/OH--φθCo(NH3)63+/Co(NH3)62+ = 0.401-0.04 = 0.361V
即Co(NH3)62+ 在氨水介質中不穩定,會被空氣中的氧氣氧化為Co(NH3)63+