定義
使用不同的指示電極,電位滴定法可以進行酸鹼滴定,氧化還原滴定,配合滴定和沉澱滴定。酸鹼滴定時使用PH玻璃電極為指示電極,在氧化還原滴定中,可以從鉑電極作指示電極。在配合滴定中,若用EDTA作滴定劑,可以用汞電極作指示電極,在沉澱滴定中,若用硝酸銀滴定鹵素離子,可以用銀電極作指示電極。在滴定過程中,隨著滴定劑的不斷加入,電極電位E不斷發生變化,電極電位發生突躍時,說明滴定到達終點。用微分曲線比普通滴定曲線更容易確定滴定終點。
如果使用自動電位滴定儀,在滴定過程中可以自動繪出滴定曲線,自動找出滴定終點,自動給出體積,滴定快捷方便。
進行電位滴定時,被測溶液中插入一個參比電極,一個指示電極組成工作電池。隨著滴定劑的加入,由於發生化學反應,被測離子濃度不斷變化,指示電極的電位也相應地變化。在等當點附近發生電位的突躍。因此測量工作電池電動勢的變化,可確定滴定終點。
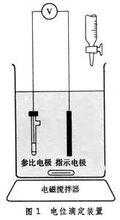
儀器裝置
 滴定管
滴定管包括滴定管、滴定池、指示電極、參比電極。
確定終點
用繪製電位確定曲線的方法。
 裝置
裝置電位滴定曲線即是隨著滴定的進行,電極電位值(電池電動勢)E對標準溶液的加入體積V作圖的圖形。
根據作圖的方法不同,電位滴定曲線有三種類型,E-V曲線,普通電位滴定曲線,拐點e即為等當點。
拐點的確定:作兩條與滴定曲線相切的45°傾斜的直線,等分線與曲線的交點即是拐點。
Ee為等當點電位。
Ve為等當點所需加的標準溶液的體積。
電位突躍範圍和斜率越大,分析誤差就越小。
曲線,一次微商曲線,一階導數曲線。
曲線峰頂e點即為等當點,(作圖時需先求出 )
用相鄰兩次的E,V值求:
。
=0時為等當點
式中的V1、V2為 值的計算值。
特點
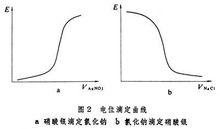 電位滴定曲線
電位滴定曲線電位滴定法比起用指示劑的容量分析法有許多優越的地方,首先可用於有色或混濁的溶液的滴定,使用指示劑是不行的;在沒有或缺乏指示劑的情況下,用此法解決;還可用於濃度較稀的試液或滴定反應進行不夠完全的情況;靈敏度和準確度高,並可實現自動化和連續測定。因此用途十分廣泛。
套用
按照滴定反應的類型,電位滴定可用於中和滴定(酸鹼滴定)沉澱滴定,絡合滴定,氧化還原滴定。
酸鹼滴定
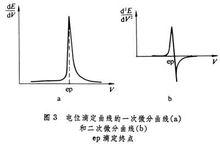 電位滴定曲線的一次微分曲線
電位滴定曲線的一次微分曲線一般酸鹼滴定都可以採用電位滴定法;特別適合於弱酸(鹼)的滴定;可在非水溶液中滴定極弱酸;
指示電極:玻璃電極,銻電極;
參比電極:甘汞電極;
(1) 在醋酸介質中用HClO₄滴定吡啶;
(2) 在乙醇介質中用 HCl 溶液滴定三乙醇胺
(3) 在異丙醇和乙二醇混合溶液中HCl 溶液滴定苯胺和生物鹼;
(4) 在二甲基甲醯胺介質中可滴定苯酚;
(5) 在丙酮介質中可以滴定高氯酸、鹽酸、水楊酸混合物。
沉澱滴定
參比電極:雙鹽橋甘汞電極;甘汞電極
(1)指示電極:銀電極
標準溶液:AgNO₃;
滴定對象:Clˉ、Brˉ、Iˉ、CNSˉ、Sˉ²、CNˉ等。
可連續滴定 Clˉ、Brˉ、Iˉ;
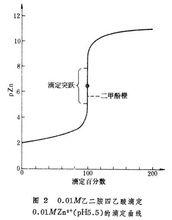 酸鹼滴定
酸鹼滴定(2) 指示電極:汞電極
標準溶液:硝酸汞;
滴定對象:Clˉ、Brˉ、Iˉ、CNSˉ、Sˉ²、C₂O₄ˉ²等。
(2)指示電極:鉑電極
標準溶液:K₄[Fe(CN)6;
滴定對象:Pd²﹢、Cd²﹢、Zn²﹢、Ba²﹢ 等。
還原滴定
參比電極:甘汞電極;
指示電極:鉑電極;
(1)標準溶液:高錳酸鉀;
滴定對象:Iˉ、NO₃ˉ、Fe²﹢、V⁴﹢、Sn²﹢、 C₂O₄²ˉ。
(2)標準溶液: K₄[Fe(CN)6;
滴定對象:Co²﹢ 。
(3)標準溶液: K₂Cr₂O7;
滴定對象: Fe²﹢ 、 Sn²﹢、 Iˉ、Sb³﹢ 等。
配位滴定
參比電極:甘汞電極;
標準溶液:EDTA
(1)指示電極:汞電極;
滴定對象:Cu²+ 、Zn²+、 Ca²+ 、 Mg²+、Al³+ 。
(2)指示電極:氯電極;
用氟化物滴定Al³+ 。
(3)指示電極:鈣離子選擇性電極;
滴定對象: Ca²+ 等。
 電位滴定法
電位滴定法
